Novinky vo farmakoterapii obezity
Updates in obesity pharmacotherapy
Obesity is a multifactorially conditioned chronic preventable disease defined by excessive fat accumulation due to an imbalance between energy intake and expenditure. It is a huge problem worldwide, independent of gender, ethnicity and age. The number of obese people is constantly increasing. Pharmacological treatment is an important part of obesity management in addition to lifestyle changing. In the European Union, we currently have three drugs for chronic obesity treatment: orlistat, a combination of naltrexone SR / bupropion SR and liraglutide 3.0 mg. Up to now, the expectations we have had regarding to the available pharmacotherapy of obesity have not been met in terms of safety, efficacy and, in particular, long-term sustainability of reduced weight. The future of personalized obesity pharmacotherapy is based on the concept of developing multilevel drugs with minimal adverse events. Looking at the results of preclinical and clinical trials, it is clear that the treatment of type 2 diabetes mellitus and / or obesity will continue to develop the multifunctional peptides – dual, respectively triple (possibly quadruple) agonists that represent more than one pharmacological activity.
Keywords:
bupropion SR – liraglutide – multifunctional peptides – naltrexone SR – pharmacotherapy of obesity – semaglutide
:
Ubomíra Fábryová 1,2
:
Metabol KLINIK s. r. o., Ambulancia pre diabetológiu, poruchy látkovej premeny a výživy, Špecializovaná lipidologická ambulancia, MED PED centrum, Bratislava
1; Biomedicínske centrum SAV, Bratislava
2
:
Forum Diab 2019; 8(2): 71-79
:
Review Article
Obezita je multifaktoriálne podmienené chronické preventabilné ochorenie definované excesívnou akumuláciou tuku v dôsledku nerovnováhy medzi príjmom a výdajom energie. Predstavuje celosvetovo obrovský problém, nezávislý od pohlavia, etnicity a veku. Počet obéznych osôb neustále narastá. Dôležitú súčasť manažmentu obezity tvorí popri zmene životného štýlu farmakologická liečba. V Európskej únii máme v súčasnosti schválené 3 lieky na chronickú liečbu obezity: orlistat, kombináciu naltrexón SR/bupropión SR a liraglutid 3,0 mg, na Slovensku máme momentálne k dispozícii iba kombináciu naltrexón/bupropión. Doposiaľ sa nenaplnili očakávania, ktoré sme mali v súvislosti s dostupnou farmakoterapiou obezity z pohľadu bezpečnosti, účinnosti a najmä dlhodobej udržateľnosti zredukovanej hmotnosti. Budúcnosť personalizovanej farmakoterapie obezity spočíva v koncepcii vývoja liekov s viacúrovňovým účinkom s minimálnymi vedľajšími nežiaducimi udalosťami. Pri pohľade na výsledky predklinických a klinických skúšaní je zrejmé, že liečba diabetes mellitus 2. typu alebo obezity bude v ďalšom smerovať k vývoju multifunkčných peptidov – duálnych, resp. 3-násobných (možno aj 4-násobných) agonistov, ktoré reprezentujú viac ako jednu farmakologickú aktivitu.
Klíčová slova:
bupropion SR – farmakoterapia obezity – liraglutid – multifunkčné peptidy – naltrexón SR – semaglutid
Úvod
Obezita je multifaktoriálne podmienené chronické preventabilné ochorenie definované excesívnou akumuláciou tuku v dôsledku nerovnováhy medzi príjmom a výdajom energie. Predstavuje celosvetovo obrovský problém, nezávislý od pohlavia, etnicity a veku.
Obezita súvisí s mnohopočetnými mechanickými a kardiometabolickými komplikáciami. V dospelej populácii zodpovedá za 80 % prípadov rozvoja diabetes mellitus 2. typu (DM2T), 35 % prípadov ischemickej choroby srdca (ICHS), 55 % prípadov artériovej hypertenzie (AHT), zodpovedá za nárast nádorových ochorení, depresií, čo všetko následne vedie k zvýšenej chorobnosti a úmrtnosti [1].
Situácia je skutočne alarmujúca, má vplyv na socioekonomický status a pretavuje sa do obrovských priamych a nepriamych ročných nákladov zdravotníckeho a sociálneho systému (strata produktivity, chorobnosť, vyplácanie dávok) [2]. Významné sú aj ďalšie dôsledky obezity: diskriminácia, sociálne vylúčenie, nerovnosť, nezamestnanosť, psychická záťaž, atď.
Fakt, že obezita je chronické komplexné ochorenie, ktoré ovplyvňujú mnohé faktory (genetika, epigenetika, biológia, ekonomické, psychosociálne a behaviorálne determinanty), je stále viac akceptovaný. Redukcia a následne udržanie zredukovanej hmotnosti je mimoriadne náročné, najmä pri adaptačnej biologickej odpovedi, ktorá nastáva ako odozva na redukciu hmotnosti napriek pretrvávajúcemu obmedzeniu energetického príjmu.
Každodenne sa zaoberáme aj ďalšími chronickými ochoreniami, ktoré veľmi úzko súvisia s obezitou, ako je DM2T, AHT, poruchy metabolizmu lipidov a lipoproteínov – dyslipoproteinémie (DLP), nealkoholová steatohepatitída (NASH), obštrukčné spánkové apnoe (OSA). Úspešný manažment obezity si často vyžaduje pridanie farmakologickej intervencie s cieľom posilniť kognitívno-behaviorálnu terapiu s udržaním negatívnej energetickej bilancie (schéma 1). Farmakoterapia obezity je dôležitou súčasťou personalizovaného manažmentu obéznych pacientov.

Prevalencia nadhmotnosti/obezity
V roku 2016 malo podľa údajov Svetovej zdravotníckej organizácie (SZO) nadváhu viac ako 1,9 miliardy dospelých osôb starších ako 18 rokov. Z nich viac ako 650 miliónov bolo obéznych. V tom istom roku malo nadváhu alebo obezitu 41 miliónov detí vo veku do 5 rokov a viac ako 340 miliónov detí a adolescentov vo veku 5–19 rokov [1]. Väčšina svetovej populácie žije v krajinách, v ktorých nadváha i obezita zabíja viac ľudí ako podváha. Prevalencia nadhmotnosti a obezity sa v európskych krajinách pohybuje v dospelej populácii okolo 50 %.
V roku 2014 roku bola priemerná dĺžka života (life expectancy – LE) slovenských žien 80,5 a mužov 73,3 roka, čo je menej ako priemerná dĺžka života v 28 krajinách Európskej Únie (EÚ) – 78,1 rokov pre mužov a 83,6 rokov pre ženy. Slovensko medzinárodne zaostáva v dosahovaní tzv. zdravej dĺžky života (healthy life years at birth – HLYs) u oboch pohlaví. V roku 2014 sme dosiahli 3. najhoršie miesto pre mužov a najhoršie miesto pre ženy medzi 28 krajinami EÚ, ale v porovnaní s rokom 2010 dosiahla Slovenská republika zlepšenie v rámci krajín V4 (Česká republika, Poľsko, Maďarsko, Slovenská republika) [3].
K tomuto nepriaznivému trendu oproti ostatnej Európe prispieva jednak nárast obezity, ale aj kardiometabolických ochorení súvisiacich s obezitou (diabezita, AHT, dyslipidémia), ktoré sú významnými rizikovými faktormi pre kardiovaskulárnu morbiditu a mortalitu. Treba si uvedomiť, že všetky uvedené ochorenia patria medzi preventabilné, čiže sa im dá predchádzať [4]. Podľa údajov z roku 2012 sa v pásme nadhmotnosti a obezity nachádzali približne dve tretiny slovenskej dospelej populácie. 7 z 10 slovenských mužov vo veku 18–64 rokov a 6 z 10 slovenských žien rovnakého veku má nadhmotnosť alebo obezitu. 1 zo 4 mužov a 1 zo 4 žien má obezitu (BMI ≥ 30 kg/m2) a III. stupeň obezity (BMI ≥ 40 kg/m2 ) má viac ako 1 % slovenskej dospelej populácie [5].
Údaje o situácii v detskej populácii máme z projektu European Childhood Obesity Surveillance Initiative (COSI), organizovaného SZO. Prevalencia nadváhy/obezity bola u chlapcov 17,1/14,9 % podľa WHO, 13,8/8,8 % podľa International Obesity TaskForce (IOTF) a 9,9/8,8 % podľa národných kritérií. Medzi dievčatami prevalencia dosiahla 15,1/11,1 %; 12,6/8,1 % a 7,5/9,5 %, čo zodpovedalo priemeru európskych krajín. Abdominálnaa obezita bola identifikovaná u 76,9 % detí s nadváhou/obezitou, ale aj u 5,9 % detí s normálnou hmotnosťou [6].
Vďaka Health Behaviour in School-aged Children Survey (HBSC) – projektu SZO, ktorý prebehol v rokoch 2009/2010, je nám čiastočne známa situácia medzi slovenským adolescentami. V tomto projekte malo nadhmotnosť/obezitu 29 % chlapcov a 13 % dievčat vo veku 11 rokov, 28 % chlapcov a 10 % dievčat vo veku 13 rokov a 18 % a 8 % 15-ročných chlapcov a dievčat (údaje získané nahlásením hmotnosti a výšky) [7].
Antiobezitiká schválené v Európskej únii
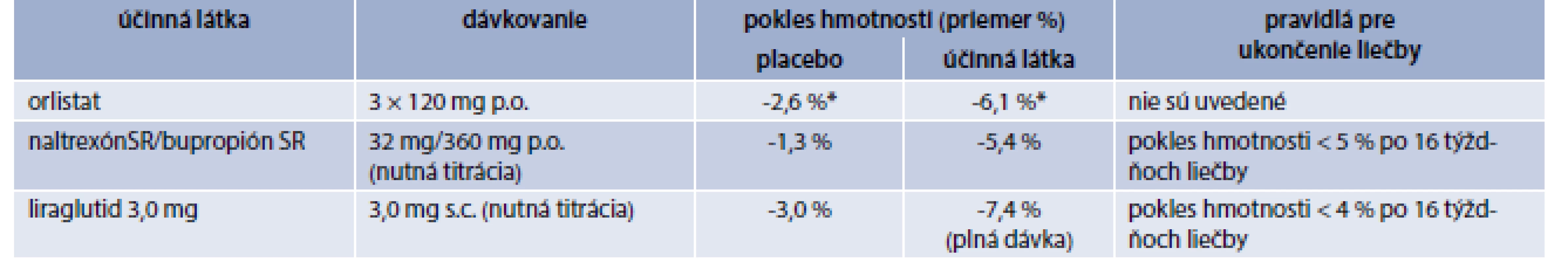
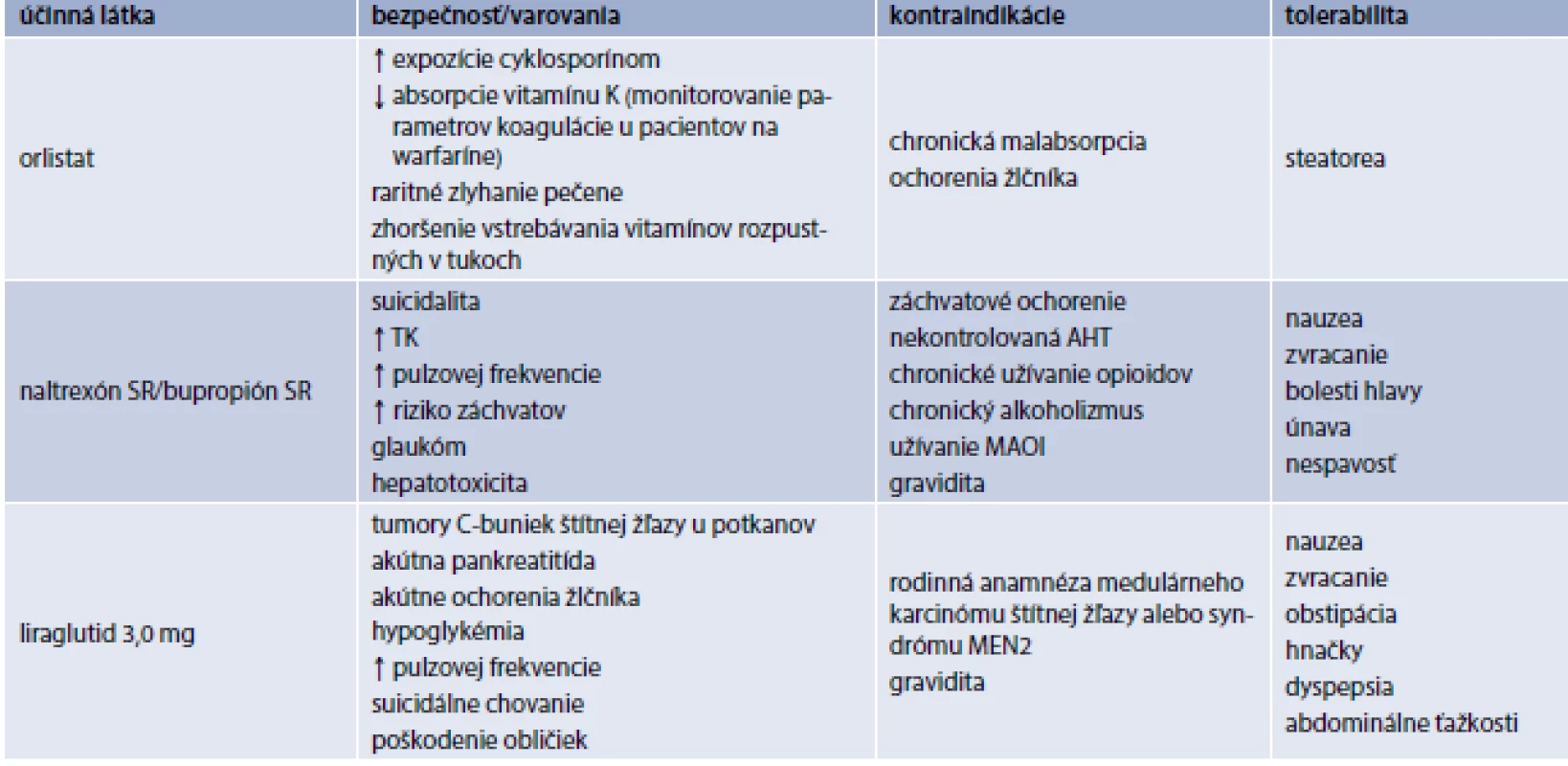
V Európskej únii máme v súčasnosti schválené 3 lieky na chronickú liečbu obezity: orlistat, kombináciu naltrexón SR/bupropión SR a liraglutid 3,0 mg (tab. 2, tab. 3). V USA na dlhodobú chronickú liečbu obezity schválil Americký úrad pre kontrolu potravín a liečiv (Food and Drug Administration – FDA) okrem uvedených 3 liekov aj lorkaserín a fentermín/topiramát ER (s postupným uvoľňovaním).
![Súčasné odporúčania pre liečbu obezity a reálne ciele pre redukciu hmotnosti. Upravené podľa [9]](https://www.forumdiabetologicum.sk/media/cache/resolve/media_object_image_small/media/image_pdf/9f5418c6cadef1905d5e936ba73228a5.png)
↑ nárast ↓ pokles
Napriek väčšej dostupnosti nie je liečba antiobezitikami dostatočne využívaná. Hoci veľká časť pacientov spĺňa kritériá pre farmakoterapiu obezity (tab. 1) [8], iba veľmi malá časť antiobezitiká užíva [9,10]. Dôvodov je samozrejme viacej: obezita väčšinou nie je považovaná za chorobu, heterogenicita obéznej populácie, nedostatok dôvery v uvedenú liečbu, zlá perzistencia pacientov na antiobezitickej liečbe, nedostatočná edukácia lekárov, neadekvátne ohodnotenie poskytovateľov zdravotnej starostlivosti, ktorí sa venujú náročnému manažmentu obéznych pacientov, nedostatočná kompliancia pacientov, atď [10].
V Slovenskej republike máme momentálne pre našich pacientov k dispozícii na chronický manažment obezity iba kombináciu naltrexón SR/bupropión SR [11–13]. Sumarizácia praktických informácií je uvedená v tab. 4. Hoci liraglutid 3,0 mg nemáme k dispozícii pre našich pacientov, pre komplexnosť uvádzame sumárne informácie v tab. 5 [11–15].


Nové ciele vo farmakoterapii obezity
Doposiaľ sa nenaplnili očakávania, ktoré sme mali v súvislosti s dostupnou farmakoterapiou obezity z pohľadu bezpečnosti, účinnosti a najmä dlhodobej udržateľnosti zredukovanej hmotnosti. Budúcnosť personalizovanej farmakoterapie obezity spočíva v koncepcii vývoja liekov s viacúrovňovým účinkom (centrálny nervový systém – periféria) s minimálnymi vedľajšími účinkami.
V súčasnosti sa veľké množstvo potenciálnych antiobezitík nachádza v rôznych štádiách vývoja a výskumu, ako aj v rôznych fázach klinického skúšania. Potenciálne antiobezitiká v 2. a 3. fáze klinického skúšania sumarizujú tab. 6 a tab. 7 [16]. V 1. fáze klinického skúšania sa nachádzajú dlhoúčinkujúce analógy amylínu, analógy fibroblastového rastového faktora 21, agonista beta-3-adrenergných receptorov, analógy oxyntomodulínu, v rámci kombinovanej liečby tri-agonisty receptorov GLP1R/GCGR/GIPR (glucagon like peptide – glukagónu podobný peptid 1/glukagón/glukózo-dependentný inzulínotropný peptid), duálne agonisty GLP1R/GCGR, kombinácia analógov glukagónu a GLP1, peptidu YY a GLP1 analógu [16].
![Potenciálne antiobezitiká v 3. fáze klinického skúšania. Upravené podľa [16]](https://www.forumdiabetologicum.sk/media/cache/resolve/media_object_image_small/media/image_pdf/0b1bcb49ed1a9645036f8ffeb64049d0.png)
*POMC deficiencia, deficiencia leptínového receptora, Bardetov-Biedlov syndróm, Alströmov syndróm
![Potenciálne antiobezitiká v 2. fáze klinického skúšania. Upravené podľa [16]](https://www.forumdiabetologicum.sk/media/cache/resolve/media_object_image_small/media/image_pdf/bc6aef297058d5e57a4679f487f86de3.png)
Ako vidíme, základný výskum sa sústredí na viaceré oblasti pôsobenia antiobezitík (redukcia apetítu alebo navodenie sýtosti cestou účinku na serotonínergné, noradrenergné, dopamínergné, opioidné, kanabinoidné alebo špecifické hormonálne receptory v mozgu, zvýšenie výdaja energie, oxidácie tukov prostredníctvom aktivácie katecholamínergných mechanizmov v CNS alebo periférnych tkanivách, redukcie absorpcie tukov cestou inhibície lipázy v tráviacom trakte a indukcie deplécie nutrientov (napr. blokáda reabsorpcie glukózy v obličkách).
Výskum sa tiež zameriava na vývoj kombinovanej liečby založenej na ovplyvnení črevných hormónov v snahe napodobiť hormonálno-humorálne-endokrínne prostredie, k vytvoreniu ktorého dochádza po bariatrickej/metabolickej chirurgii, najmä po RYGB (Roux-en-Y gastrický bypass) a VSG (vertikálna rukávová gastrektómia). Ideálna antiobezitická farmakoterapia by mala byť vyspelejším modelom bariatrickej medicíny, v ktorej by črevné hormóny pôsobili synergicky a v komplementárnom režime na indukciu lipolýzy, zvýšenie výdaja energie a obnovenie porúch systému energetickej homeostázy bez ovplyvnenia základných systémových funkcií (napr. reprodukcia, neurobehaviorálne funkcie). Doterajšie výskumy naznačujú, že injekčné formy vykazujú lepšiu biologickú dostupnosť a farmakokinetiku (viacnásobná aplikácia injekčne podávaných krátkodobo a dlhodobo účinkujúcich liekov).
Novou a vzrušujúcou oblasťou výskumu je genetika obezity. Príchod celogenómových asociačných štúdií (Genome Wide Association Studies – GWAS) urýchlil vývoj polygénneho výskumu obezity. V súčasnosti bolo identifikovaných prostredníctvom GWAS najmenej 75 lokusov súvisiacich s obezitou v rôznych etnických skupinách. Lepšie pochopenie ich vzťahu k obezite môže v konečnom dôsledku viesť k novým cieľom v oblasti vývoja liekov, k účinnejším stratégiám prevencie a nakoniec aj účinnejšej personalizovanej medicíne [17].
Mechanizmus účinku agonistov receptora GLP1 v liečbe obezity
GLP1 je inkretínový hormón vylučovaný L-bunkami tenkého čreva. Stimuluje produkciu inzulínu a inhibuje sekréciu glukagónu z pankreatických ostrovčekov glukózodependentým spôsobom, čo vedie k poklesu glykémie.
GLP1Ra (agonisty receptora glukagónu podobnému peptidu 1) napodobňujú účinky natívneho GLP1 hormónu aktivaciou GLP1-receptora.
Randomizované klinické štúdie potvrdili, že GLP1Ra vedú k redukcii hmotnosti a glykémie u ľudí s nadváhou/obezitou, diabetikov aj nediabetikov.
GLP1-receptor sa nachádza v celom tele, sprostredkováva viacero fyziologických účinkov (pri liečbe obezity sú najdôležitejšie anorexigénne a inzulínotropné účinky). Predpokladá sa, že anorexigénny účinok aktivovaného receptora GLP1 pôsobí periférnym aj centrálnym mechanizmom [18].
Centrálne GLP1Ra môžu prechádzať hematoencefalickou bariérou a viazať sa v hypotalamických oblastiach, najmä v nucleus arcuatus a paraventrikulárnom jadre. Nucleus arcuatus integruje a reaguje na sýtosť a hladové signály, vytvára počiatky centrálnej nervovej reakcie na poruchy v energetickej bilancii. Neuróny nucleus arcuatus obsahujú neuropeptid Y (NPY) a proteín príbuzný s agouti proteínom (agouti related protein – AgRP).
GLP1Ra prostredníctvom pôsobenia na neurónovej skupine orexigénneho NPY/AgRP vedú k uvoľneniu gama-aminomaslovej kyseliny (GABA), čo môže viesť k zníženiu chuti do jedla.
Na periférnej úrovni GLP1Ra pôsobia na aferentné vagálne neuróny. GLP1Ra tiež spomaľujú vyprázdňovanie žalúdka, ale tento účinok sa nezdá byť absolútnou primárnou príčinou úbytku hmotnosti indukovaného GLP1Ra. Okrem toho sa predpokladá, že účinok redukcie hmotnosti po liečbe GLP1Ra je ovplyvnený znížením cirkulujúceho leptínu po úbytku hmotnosti vyvolanom GLP1Ra, čo môže viesť k ďalšiemu zvýšeniu anorexigénneho účinku. Dnes nemáme k dispozícii konzistentné dôkazy pre zmenu výdaja energie spôsobenej alteráciou pokojového metabolizmu alebo diétou indukovanej termogenézy. GLP1Ra zvyšujú pocit sýtosti, čo vedie k zníženému príjmu potravy a negatívnej energetickej bilancii s úbytkom hmotnosti [16]. V súčasnosti dostupné GLP1Ra sú exenatid, liraglutid, lixisenatid, albiglutid, dulaglutid a semaglutid, z ktorých všetky sú schválené na liečbu DM2T. Na liečbu obezity je v súčasnosti schválený (FDA – Food and Drug Administration, EMA – European Medicines Agency) len liraglutid 3,0 mg. Semaglutid sa momentálne nachádza už v 3. fáze klinického skúšania.
Semaglutid
Semaglutid je ľudský analóg GLP1 s 94% homológiou s natívnym GLP1, s podobnou štruktúrou ako liraglutid (je určený ako na liečbu pacientov s DM2T, tak aj obéznych pacientov nediabetikov). Oproti liraglutidu má tri dôležité modifikácie: substitúcia aminokyseliny v polohe 8 chráni semaglutid pred degradáciou dipeptidyl peptidázou 4 (DPP4); acylácia lyzínu peptidovej kostry a C18 mastná di-kyselina v polohe 26 poskytuje silnú, špecifickú väzbu na albumín a ďalšia substitúcia aminokyselín v polohe 34 zabraňuje väzbe C18 mastných di-kyselín na nesprávnom mieste.
Tieto modifikácie zvýšili 3-násobne afinitu semaglutidu v porovnaní s liraglutidom a predĺžili biologický polčas semaglutidu na 165 hodín u ľudí (približne jeden týždeň), čo dovoľuje jeho injekčnú aplikáciu raz do týždňa. V porovnaní s prvou generáciou GLP1Ra, ktoré sa podávajú raz/dvakrát denne dochádza k výraznému zlepšeniu kompliancie a kvality života pacienta. Semaglutid vedie v závislosti od dávky k redukcii HbA1c, ako aj hmotnosti u diabetikov. FDA (2017) a EMA (2018) schválili semaglutid v maximálnej dávke 1,0 mg podávaný subkutánne na liečbu diabetikov 2. typu, ale ešte nie je schválený na liečbu obezity [18].
V roku 2020 by mali byť ukončené štyri štúdie 3. fázy klinického skúšania (STEP 1–4). Podľa požiadaviek FDA by sme mali mať v roku 2023 výsledky kardiovaskulárnej štúdie Semaglutide Effects on Cardiovascular Outcomes in People with Overweight or Obesity (SELECT). Do štúdie by malo byť randomizovaných 17 500 účastníkov a bude porovnávať denné subkutánne injekcie semaglutidu s placebom počas 31–59 mesiacov u nediabetikov s nadhmotnosťou/obezitou s predchádzajúcim kardiovaskulárnym ochorením [19].
V roku 2018 boli publikované výsledky randomizovanej, dvojito zaslepenej, placebom a aktívnou látkou kontrolovanej, multicentrickej štúdie 2. fázy klinického skúšania. Štúdia prebiehala v ôsmich krajinách, zaradených bolo 957 (po 102–103 v aktívnych liečebných ramenách a 136 v skupine liečenej placebom) dospelých osôb (≥ 18 rokov), nediabetikov s BMI ≥ 30 kg/m2. Priemerný vek bol 47 rokov, telesná hmotnosť 111,5 kg a BMI 39,3 kg/m2. Pacienti boli randomizovaní v pomere 6 : 1 v každej aktívne liečenej skupine, napr. semaglutid (0,05 mg, 0,1 mg, 0,2 mg, 0,3 mg alebo 0,4 mg; iniciačná dávka bola 0,05 mg/deň, zvyšovaná každé 4 týždne) alebo liraglutid (3,0 mg; iniciačná dávka bola 0,6 mg/deň a každý týždeň bola zvyšovaná o 0,6 mg až do dávky 3,0 mg) alebo placebo (rovnaká dávka a zvyšovanie dávky ako v skupinách s aktívnou liečbou). Všetky medikamenty boli podávané raz denne subkutánne. Primárnym endpointom bolo percento poklesu hmotnosti v 52 týždni.
Priemerná strata hmotnosti bola -2,3 % v placebovej skupine oproti -6,0 % (0,05 mg), -8,6 % ( 0,1 mg), -11,6 % (0,2 mg), -11,2 % (0,3 mg) a -13,8 % (0,4 mg) pre skupiny užívajúce semaglutid. Pokles hmotnosti oproti placebu bol vo všetkých skupinách signifikantný (p < 0,0010). Priemerný pokles hmotnosti pre semaglutid ≥ 0,2 mg bol signifikantne významný oproti liraglutidu (-13,8 % až -11,2 % oproti -7,8 %). Pokles hmotnosti ≥ 10 % sa vyskytol u 10 % účastníkov užívajúcich placebo oproti 37–65 % pacientov užívajúcich ≥ 0,1 mg semaglutidu (p <0,0001 oproti placebu). Všetky dávky semaglutidu boli všeobecne dobre tolerované, najčastejšie nežiaduce udalosti boli gastrointestinálne symptómy závislé od dávky, predovšetkým nevoľnosť (postupný ústup v priebehu štúdie), veľmi podobne ako u ostatných GLP1Ra. Liečba semaglutidom tiež indukovala zvýšenie priemernej pokojovej tepovej frekvencie približne 2–3 údery/min v porovnaní s placebom [20].
Randomizovaná dvojito zaslepená, placebom kontrolovaná štúdia s dvojfázovým krížením skúmala efekt 12-týždňovej liečby semaglutidom (1-krát do týždňa, podávaný subkutánne, s eskaláciou dávky na 1,0 mg) u 30 obéznych osôb. V rámci štúdie boli hodnotené: celkový energetický príjem ad libitum, chuť do jedla, smäd, nevoľnosť, pocit pohody, kontrola jedenia, preferencia potravín, rýchlosť pokojového metabolizmu, telesná hmotnosť a zloženie tela. Semaglutid v porovnaní s placebom viedol po štandardizovaných raňajkách k nižšiemu príjmu energie počas obeda (-1255 kJ; p < 0,0001), počas nasledujúceho večera (p = 0,4040) a aj občerstvenia (p = 0,0034), čo viedlo k 24% zníženiu celkového príjmu energie počas celého dňa (-3036 kJ; p < 0,0001). Semaglutid oproti placebu viedol k zlepšeniu skóre supresie apetítu nalačno, zatiaľ čo hodnotenie prítomnosti nauzey bolo veľmi podobné. Semaglutid bol spojený s nižším pocitom hladu, s nižším „bažením“ po jedle, lepšou kontrolou jedenia a nižšou preferenciou potravín s vysokým obsahom tuku. Rýchlosť pokojového metabolizmu adjustovaná na chudú telesnú hmotnosť nevykazovala rozdiel medzi liečebnými ramenami. Semaglutid viedol k redukcii hmotnosti o 5,0 kg, predovšetkým redukciou telesného tuku. Po 12-týždňovej liečbe semaglutidom bol príjem energie ad libitum podstatne nižší v porovnaní s placebom, so zodpovedajúcou redukciou hmotnosti. Popri zníženom energetickom príjme, do úvahy prichádzajú aj ďalšie mechanizmy vedúce k redukcii hmotnosti semaglutidom – zníženie chuti do jedla, lepšiu kontrolu jedenia, nižšia preferencia mastných, energeticky náročných potravín [21].
Štúdie so semaglutidom u diabetikov 2. typu ukázali, že redukcia hmotnosti sa v porovnaní s placebom hýbala od 3,6 do 5,7 kg. Obézni nediabetici dosiahli pokles hmotnosti o 11,6 %, tento úbytok hmotnosti bol o 5,5 % vyšší v porovnaní s úbytkom hmotnosti pri liečbe liraglutidom 3,0 mg v rovnakej štúdii, čo veľmi silne favorizuje semaglutid [20].
V štúdiách zameraných na diabetikov a obéznych nediabetikov bol výskyt nežiadúcich udalostí pri podávaní liraglutidu, či semaglutidu veľmi podobný. Najčastejšie vyskytujúcimi sa nežiaducimi udalosťami boli gastrointestinálne ťažkosti (nauzea, zvracanie, hnačka, obstipácia), ktoré boli mierne až stredne závažné (15–38 % pri placebe, 38–82 % pri semaglutide). Nevoľnosť pri užívaní semaglutidu, podobne ako pri liraglutide, bola väčšinou prítomná v titračnom období a časom sa znižovala [18].
Multifunkčné peptidy v liečbe obezity a prevencii diabetes mellitus
Zdá sa, že terapia obezity jednou účinnou látkou príliš nefunguje. Máme veľa vedomostí o tom, že cirkulujúce črevné hormóny výrazným spôsobom kontrolujú pocit sýtosti a telesnú hmotnosť. Na dosiahnutie podstatného úbytku hmotnosti, ale najmä dlhodobého udržania zredukovanej hmotnosti sa však musíme súčasne zamerať na dve alebo aj viac „anorektických“ ciest. Pri pohľade na predklinické a klinické skúšanie je zrejmé, že personalizovaná liečba DM2T alebo obezity bude v ďalšom smerovať k vývoju multifunkčných peptidov – duálnych, resp. 3-násobných (možno aj 4-násobných) agonistov, ktoré reprezentujú viac ako jednu farmakologickú aktivitu. Možnosti kombinácie ďalších peptidov s GLP1 zahŕňajú glukagón (GCG), glukózo-dependentný inzulínotropný peptid (GIP), cholecystokinín B (CCKB) a peptid podobný glukagónu 2 (GLP2). Výskum je najďalej pri duálnych agonistoch GLP1-GIP a GLP1-GCG. Pri duálnych agonistoch GLP1-GCG anorektický efekt agonizmu GLP1 pôsobí synergicky s glukagónom, ktorý zvyšuje energetický výdaj a výsledkom je vyššia redukcia hmotnosti. Od duálnych agonistov očakávame pravdepodobne väčší efekt na redukciu hmotnosti u obéznych diabetikov ako od čistých GLP1Ra. Ďalším príkladom je duálny agonista GLP1-CCKB, pri ktorom pridanie CCKB agonistu ku GLP1 obmedzuje hyperglykemický účinok glukagónu, zlepšuje citlivosť na inzulín, vedie k zlepšeniu funkcie B-buniek pankreasu (prevencia progresie DM2T), ako aj ku redukcii hmotnosti [22,23].
Tieto príklady ilustrujú, ako môže pridanie ďalšieho peptidu k bežnému efektu GLP1 viesť k individualizovanejšiemu liečebnému riešeniu s vyššou účinnosťou.
V literatúre sú zmienky aj o 3-agonistoch inkretínu (GLP1–GIP–GCG) so silnými antiobezitickými a antidiabetickými účinkami. Zlepšenie metabolického syndrómu bolo sledované v štúdii s 3-agonistami, ktorá porovnávala ich efekt u myších samcov oproti samičkám (obezita bola indukovaná diétou). Efekt 3-agonistov ovplyvnil metabolický syndróm u samčekov, zatiaľ čo metabolický efekt u samičiek sa nepotvrdil [20]. Ďalšia práca však potvrdzuje, že 3-agonisty viedli ku zlepšeniu obezity, steatohepatitídy a dyslipidémie u samíc myší [24].
Dokonca sa môžeme dočítať aj o multifunkčných peptidoch zameraných na 4 rôzne receptory, čo je chemicky uskutočniteľné, ale zatiaľ iba v počiatočných fázach predklinického výskumu [22,23].
Multifunkčné peptidy môžu chemicky predstavovať hybrid dvoch (alebo viacerých) peptidov (peptidy sú navzájom spojené ako moduly alebo prepojené linkerom) alebo chiméry, pri ktorých je druhý peptid „dizajnovaný“ na existujúcu peptidovú kostru (schéma 2) [22].
Záver
Podľa súčasných štatistických údajov pochádzajúcich z celého sveta je veľmi malá pravdepodobnosť, že by miera obezity klesala, práve naopak neustále relatívne rýchlo narastá skupina pacientov s III. stupňom obezity (BMI ≥ 40 kg/m2). Obezita je v klinickej praxi nedostatočne liečená, dôvodom je aj to, že v mnohých krajinách nie je považovaná za chronickú celoživotnú chorobu, čím sa upiera pacientom právo na reálnu pomoc. Dôvodom by malo byť najmä to, že obezita generuje ďalšie chronické ochorenia, a to nielen kardiometabolické (DM2T, AHT, adipozopatická dyslipidémia, infarkt myokardu, cievna mozgová príhoda, poruchy srdcového rytmu), ale aj nádorové a neurodegeneratívne (Alzheimerova a Parkinsonova choroba). V súčasnosti nám chýba ako primárna, tak aj sekundárna prevencia obezity s následnou kuratívou. Iba 1 % obéznych pacientov dostane reálnu pomoc pri manažmente obezity a ešte dôležitejšom manažmente udržania už zredukovanej hmotnosti (diétne a režimové opatrenia, kognitívno-behaviorálna terapia, farmakoterapia, bariatrická/metabolická chirurgia) [25].
![Obr. 2 | Multifunkčné peptidy v manažmente DM2T alebo obezity. Upravené podľa [19]](https://pl-master.mdcdn.cz/media/image_pdf/8f5e61890c6e7d9427d1dd4346af75f6.png?version=1566982415)
Prevencia rozvoja nadhmotnosti a obezity je prevenciou rozvoja mnohých ochorení (podľa výstupov z Obesity Week 2016 v New Orleans bolo zadefinovaných 236 komplikácií obezity).
V klinickej praxi by sme v najbližšej budúcnosti určite mali prejsť z paradigmy centrovanej na manažment komorbidít na paradigmu zameranú na manažment obezity.
Zdá sa však, že farmakoterapia obezity jedinou účinnou látkou príliš nefunguje. Na dosiahnutie podstatného úbytku hmotnosti, ale najmä dlhodobého udržania zredukovanej hmotnosti sa musíme súčasne zamerať na dve alebo aj viac „anorektických“ ciest. Pri pohľade na predklinické a klinické skúšanie je zrejmé, že personalizovaná liečba DM2T alebo obezity bude v ďalšom smerovať k vývoju multifunkčných peptidov – duálnych resp. 3-násobných (možno aj 4-násobných) agonistov, ktoré reprezentujú viac ako jednu farmakologickú aktivitu.
MUDr. Ľubomíra Fábryová, PhD.
Doručené do redakcie 13. 5. 2019
Prijaté po recenzii 21. 5. 2019
Sources
- Obesity and overweight. Dostupné z WWW: <https://www.who.int/news-room/fact-sheets/detail/obesity-and-overweight>.
- le Roux CW, Chubb B, Nørtoft E et al. Obesity and healthcare resource utilizations: results from Clinical Practice Research Database (CPRD). Obes Sci Pract 2018; 4(5): 409–416. Dostupné z DOI: <http://dx.doi.org/10.1002/osp4.291>.
- Smatana M, Pažitný P, Kandilaki D et al. Slovakia: Health system review. Health Syst Transit 2016; 18(6): 1–210. Dostupné z WWW: <http://www.healthobservatory.eu>.
- Fábryová Ľ. Súčasná situácia v manažmente obéznych pacientov na Slovensku. Koncept národného komplexného manažmentu obezity v Slovenskej republike. Forum Diab 2018; 7(2): 89–97.
- Avdičová M et al. Monitorovanie rizikových faktorov chronických chorôb v SR. RÚVZ so sídlom v Banskej Bystrici za podpory WHO – regionálnej úradovne v Kodani. 2012. ISBN 978–80- 971096–0-8.
- Tichá Ľ, Regecová V, Šebeková K et al. Prevalence of overweight/obesity among 7-year-old children-WHO Childhood Obesity Surveillance Initiative in Slovakia, trends and differences between selected European countries. Eur J Pediatr 2018; 177(6): 945–953. Dostupné z DOI: <http://dx.doi.org/10.1007/s00431–018–3137–7>.
- Currie C, Zanotti C, Morgan A et al. Social determinants of health and well-being among young people: Health Behaviour in School-aged Children (HBSC) study: international report from the 2009/2010 survey. WHO Regional Office for Europe: Copenhagen 2012 (Health Policy for Children and Adolescents, No. 6). Dostupné z WWW: <http://www.euro.who.int/en/publications/abstracts/social-determinants-of-health-and-well-being-among-young-people.-health-behaviour-in-school-aged-children-hbsc-study>. ISBN 978 92 890 1423 6.
- Yumuk V, Tsigos C, Fried M et al. European Guideline for Obesity Management in Adults. Obes Facts 2015; 8(6): 402–424. Dostupné z DOI: <http://dx.doi.org/10.1159/000442721>.
- Xia Y, Kelton CM, Guo JJ et al. Treatment of obesity: pharmacotherapy trends in theUnited States from 1999 to 2010. Obesity (Silver Spring) 2015; 23(8): 1721–1728. Dostupné z DOI: <http://dx.doi.org/10.1002/oby.21136>.
- Ganguly R, Tian Y, Kong SX et al. Persistence of newer anti-obesity medications in a real-world setting. Diabetes Res Clin Pract 2018; 143: 348–356. Dostupné z DOI: <https://doi.org/10.1016/j.diabres.2018.07.017>.
- Fábryová Ľ. Weight Loss Pharmacotherapy of Obese Non-Diabetic and Type 2 Diabetic Patients. J Obes Weight Loss Ther 2015; 5: 277. Dostupné z DOI: <http://dx.doi.org/10.4172/2165–7904.1000277>.
- Fábryová Ľ. Účinnosť a bezpečnosť moderných antiobezitík: najnovšie dôkazy a manažment pacientov. Interná Med 2016; 16(11): 447–454.
- Fábryová Ľ. Manažment obézneho pacienta. In: Martinka E et al. Interdisciplinárne štandardy diagnostiky a liečby diabetes mellitus, jeho komplikácií a najvýznamnejších sprievodných ochorení. Facta Medica 2018; 2(Suppl 1): 5–153.
- Patel DK., Stanford FC. Safety and tolerability of new generation anti-obesity medications: a narrative review, Postgrad Med 2018; 130(2): 173–182. Dostupné z DOI: <http://dx.doi.org/10.1080/00325481.2018.1435129>.
- Velazquez A, Apovian CM. Updates on obesity pharmacotherapy. Ann N Y Acad Sci 2018; 1411(1): 106–119. Dostupné z DOI: <http://dx.doi.org/10.1111/nyas.13542>.
- Pilitsi E, Farr OM, Polyzos SA et al. Pharmacotherapy of obesity: Available medications and drugs under investigation. Metabolism 2019; 92: 170–192. Dostupné z DOI: <http://dx.doi.org/10.1016/j.metabol.2018.10.010>.
- Valsamakis G, Konstantakou P, Mastorakos G. New Targets for Drug Treatment of Obesity. Annu Rev Pharmacol Toxicol 2017; 57: 585–605. Dostupné z DOI: <http://dx.doi.org/10.1146/annurev-pharmtox-010716–104735>.
- Christensen RM, Juhl RC, Torekov SS. Benefit‑Risk Assessment of Obesity Drugs: Focus on Glucagon‑like Peptide‑1 Receptor Agonists. Drug Saf 2019; 2019. Dostupné z DOI: <https://doi.org/10.1007/s40264–019–00812–7>.
- [ClinicalTrials.gov]. Semaglutide Effects on Heart Disease and Stroke in Patients With Overweight or Obesity (SELECT). NCT03574597. 2019. Dostupné z WWW: <https://clinicaltrials.gov/ct2/show/NCT03574597>.
- O’Neil PM, Birkenfeld AL, McGowan B et al. Efficacy and safety of semaglutide compared with liraglutide and placebo for weight loss in patients with obesity: a randomised, double-blind, placebo and active controlled, dose-ranging, phase 2 trial. Lancet 2018; 392(10148): 637–649. Dostupné z DOI: <https://doi.org/10.1016/s0140–6736(18)31773–2>
- Blundell J, Finlayson G, Axelsen M et al. Effects of once-weekly semaglutide on appetite, energy intake, control of eating, food preference and body weight in subjects with obesity. Diabetes Obes Metab 2017; 19(9): 1242–1251. Dostupné z DOI: <https://doi.org/10.1111/dom.12932>.
- Fosgerau K, Hoffmann T. Peptide therapeutics: current status and future directions. Drug Discov Today 2015; 20(1): 122–128. Dostupné z DOI: <http://dx.doi.org/10.1016/j.drudis.2014.10.003>.
- Sadry S, Drucker D. Emerging combinatorial hormone therapies for the treatment of obesity and T2DM. Nat Rev Endocrinol 2013; 9(7): 425–433. Dostupné z DOI: <http://dx.doi.org/10.1038/nrendo.2013.47>.
- Jall S, Sachs S, Clemmensen C et al. Monomeric GLP-1/GIP/glucagon triagonism corrects obesity, hepatosteatosis, and dyslipidemia in female mice. Molecular Metabolism 2017; 6(5): 440–446. Dostupné z DOI: <http://dx.doi.org/10.1016/j.molmet.2017.02.002>.
- Kahan S, Manson JE. Obesity Treatment, Beyond the Guidelines Practical Suggestions for Clinical Practice. JAMA 2019; 321(14): 1349–1350. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2019.2352>.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Forum Diabetologicum

2019 Issue 2
Most read in this issue
- Modern trends in the treatment of hypertension
- Updates in obesity pharmacotherapy
- Modern trends in local treatment of diabetic foot
- Insulin pump treatment in type 1 diabetes mellitus – for whom and why?
