Katétrová ablácia fibrilácie predsiení u pacientov s diabetes mellitus
Catheter ablation of atrial fibrillation in patients with diabetes mellitus
Atrial fibrillation is the most common arrhythmia in clinical practice. Diabetes mellitus is an independent risk factor for atrial fibrillation and increases the risk of atrial fibrillation by 40 %. Catheter ablation of atrial fibrillation is one of the established therapeutic procedures with proven higher effectiveness compared to drug treatment. It has a firm place in the treatment strategy of rhythm control in diabetics with several specifics that must be taken into account when selecting suitable patients. Patients with diabetes are characterized by an accumulation of risk factors for the onset and progression of atrial fibrillation. To ensure sufficient effectiveness of catheter ablation and the whole rhythm control strategy, a radical and comprehensive modification of all risk factors and comorbidities is necessary.
Keywords:
atrial fibrillation – catheter ablation – diabetes mellitus – risk factors for atrial fibrillation
Authors:
Martin Škamla; Ubica Horváthová
Authors‘ workplace:
Oddelenie arytmií SÚSCCH, a. s., Banská Bystrica
Published in:
Forum Diab 2021; 10(2): 87-92
Category:
Overview
Fibrilácia predsiení je najčastejšie sa vyskytujúca arytmia v klinickej praxi. Diabetes mellitus sa zaraďuje medzi nezávislé rizikové faktory pre vznik fibrilácie predsiení a zvyšuje riziko vzniku fibrilácie predsiení o 40 %. Katétrová ablácia fibrilácie predsiení patrí medzi etablované terapeutické postupy s preukázanou vyššou efektivitou v porovnaní s medikamentóznou liečbou. V liečebnej stratégii kontroly rytmu u diabetikov má svoje pevné miesto s viacerými špecifikami ku ktorým treba prihliadať pri selekcii vhodných pacientov. Pacienti s diabetom sú typickí kumuláciou rizikových faktorov pre vznik a progresiu fibrilácie predsiení. Pre zabezpečenie dostatočnej efektivity katétrovej ablácie a celej stratégie kontroly rytmu je potrebné ich súčasné radikálne a komplexné ovplyvnenie.
Klíčová slova:
diabetes mellitus – fibrilácia predsiení – katétrová ablácia – rizikové faktory fibrilácie predsiení
Úvod
Fibrilácia predsiení (FP) je najčastejšie sa vyskytujúca arytmia v klinickej praxi. Postihuje 2–4 % populácie a je asociovaná so zvýšenou kardiovaskulárnou morbiditou a mortalitou [1,2]. Diabetes mellitus (DM) sa zaraďuje medzi nezávislé rizikové faktory pre vznik FP. Pacient s DM má približne o 40 % vyššie riziko vzniku FP ako pacient bez diabetu [3]. Prevalencia FP ako aj diabetu má narastajúci trend a ich koexistencia rastie s dlhším trvaním a horšou kontrolou DM [3]. Prítomnosť FP u pacienta s DM má významné kardiovaskulárne dôsledky z hľadiska morbidity, mortality a prognózy. Manažment FP u diabetika vychádza zo zásad definovaných v odporúčaniach pre liečbu FP. Katétrová ablácia fibrilácie predsiení patrí medzi etablované terapeutické postupy s preukázanou vyššou efektivitou v porovnaní s medikamentóznou liečbou [2]. V liečebnej stratégii kontroly rytmu u diabetikov má svoje pevné miesto s viacerými špecifikami ku ktorým treba prihliadať pri selekcii vhodných pacientov.
Patofyziologické aspekty výskytu fibrilácie predsiení u pacienta s DM
Patofyziológia vzniku FP v teréne DM je multifaktoriálne podmienená. Pacienti s DM sú často polymorbídni, s typickou kumuláciou komorbidít a rizikových faktorov, ktoré sa v rôznej miere spolupodieľajú na etiopatogenéze FP (artériová hypertenzia, obezita, srdcové zlyhávanie, koronárna choroba, dyslipidémia, renálna insuficiencia a spánkové apnoe). FP v prostredí DM je v zásade spôsobená remo- deláciou predsieňového tkaniva, nemožno ju teda považovať za idiopatickú. Boli identifikované viaceré mechanizmy, ktoré indukujú štrukturálnu, elektrickú a autonómnu remodeláciu predsiení asociovanú s DM [4,5]. Medzi najvýznamnejšie patrí vysoká aktivita prozápalových mediátorov, zvýšená produkcia koncových produktov neenzýmovej glykácie (AGE) a profibrotických rastových faktorov (TGFβ), oxidatívny stres, chronická hyperglykémia, glykemické výkyvy, inzulínová rezistencia a endoteliálna dysfunkcia [4,5]. Základným substrátom pre FP asociovanú s DM je štrukturálna remodelácia predsiení v zmysle difúznej intersticiálnej fibrózy a dilatácie predsiení (diabetická atriálna kardiomyopatia). Fibrotizácia atriálneho myokardu sa priamo podieľa na atriálnej dysfunkcii, iniciácii, udržiavaní a progresii FP do chronických foriem [4,6]. Na predsieňovú dilatáciu, fibrotizáciu a arytmogenézu má súčasne výrazný vplyv diastolická dysfunkcia s hemodynamickým preťažením ľavej predsiene (ĽP) pri artériovej hypertenzii a obezite [5,7]. Perzistencia FP následne tieto štrukturálne zmeny ďalej umocňuje s progresiou do chronickej FP („fibrilácia plodí fibriláciu“). Uvedené fakty majú rozsiahle klinické a terapeutické dôsledky. Štrukturálna remodelácia ĽP je v súčasnosti jednoducho vizualizovateľná pri elektroanatomickom mapovaní ĽP počas katétrovej ablácie FP metodikou vysoko denzitného mapovania pomocou špeciálnych multipolárnych katétrov (obr. 1, obr. 2). Zóny fibrotickej degenerácie tkaniva majú korelát v nižšej voltáži a patologickej frakcionácii lokálnych elektrogramov. Identifikácia týchto oblastí počas elektrofyziologického vyšetrenia môže následne priamo ovplyvňovať rozsah katétrovej ablácie fibrilácie predsiení. Pri tzv. substrátovej modifikácii ablačnými léziami ovplyvňujeme takto anatomicky zmenené miesta v ĽP, typicky zadnú stenu ĽP (box izolácia zadnej steny), strop, interatriálne septum (obr. 3, s. 90). Táto metodika sa používa ako jedna z ablačných stratégií pri katétrovej ablácii perzistujúcej FP a dlhodobo perzistujúcej FP ako doplnok k izolácii pľúcnych žíl. Autonómna remodelácia predsiení je charakterizovaná heterogénne zvýšenou lokálnou sympatikovou inerváciou, poklesom aktivity parasympatiku a autonómnou neuropatiou [5]. Elektrická remodelácia sa manifestuje spomalením a heterogenitou vedenia elektrického vzruchu, abnormalitami v trvaní akčného potenciálu a atriálnej efektívnej refraktérnej periódy. Tieto zmeny uľahčujú vznik a udržanie atriálnych tachyarytmií [5].
Archív autora
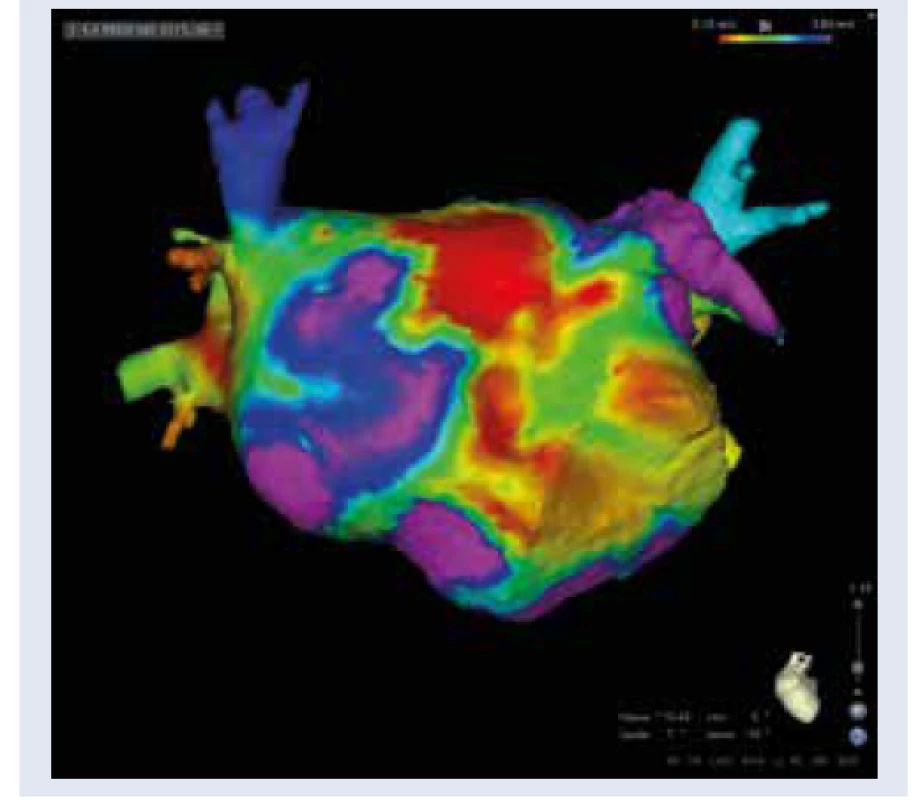
Archív autora
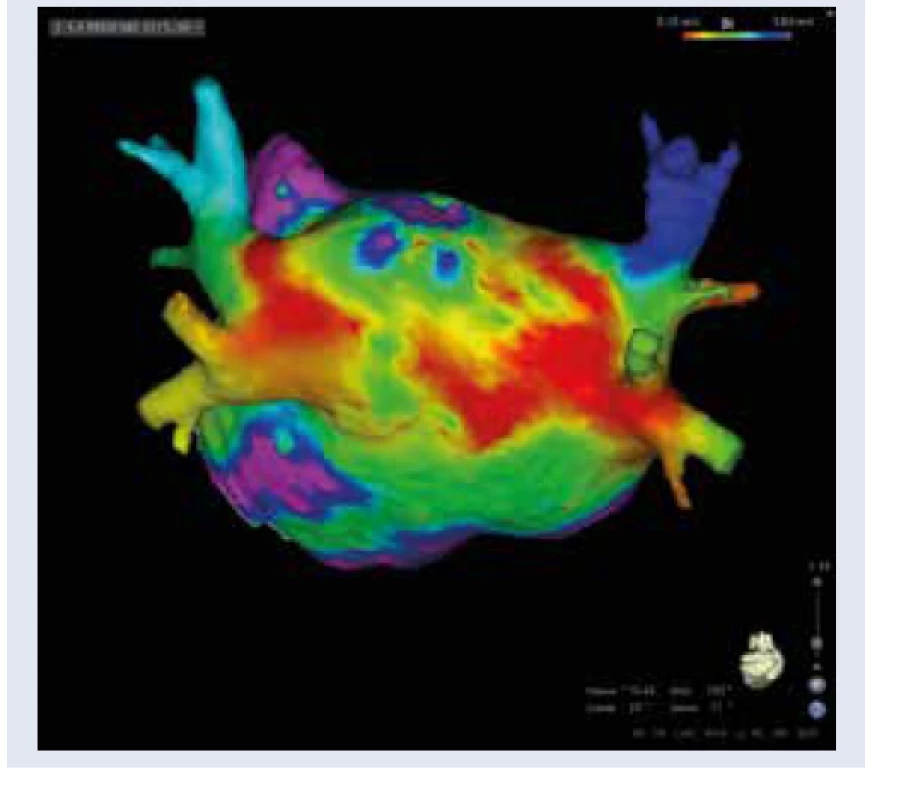
Archív autora
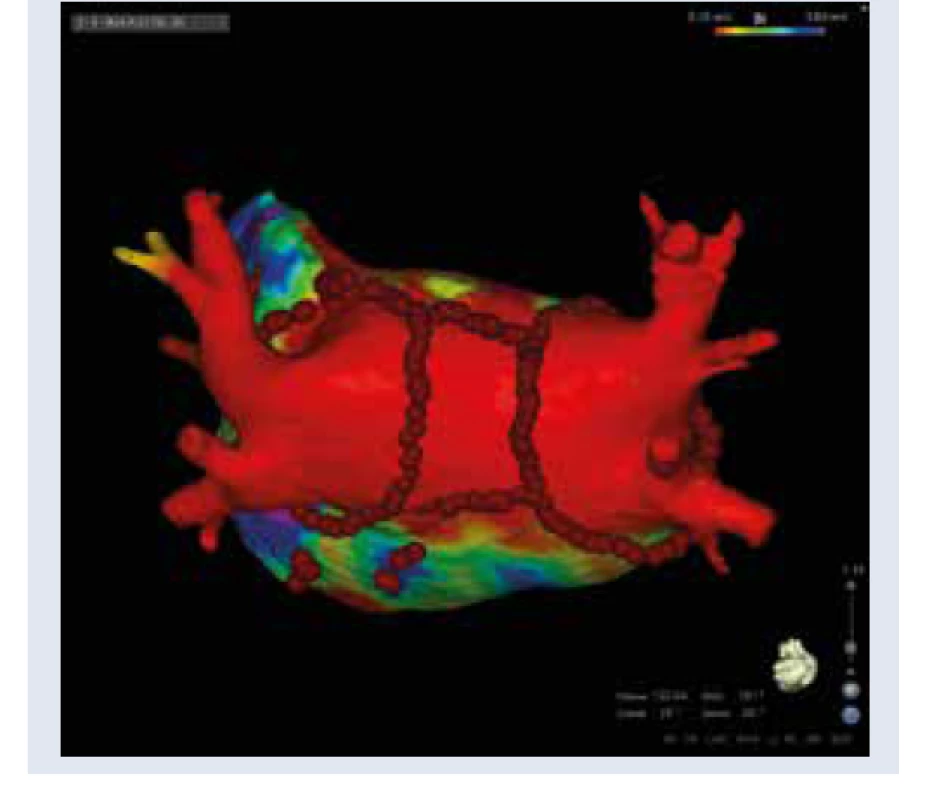
Klinické dôsledky fibrilácie predsiení u pacienta s DM
Klinické charakteristiky a dôsledky FP u diabetikov možno dobre dokumentovať na veľkom registry ORBIT-AF, ktorý analyzoval takmer 10 000 pacientov s FP [8]. DM bol diagnostikovaný u 30 % pacientov s FP. Koincidencia FP a DM bola asociovaná so signifikantným zvýšením kardiovaskulárnej a celkovej mortality, hospitalizácií, závažnejšou symptomatológiou a zníženou kvalitou života v porovnaní s pacientami s FP bez DM [8]. Pacienti s FP a DM boli mladší, mali vyšší body mass index (BMI) a častú anamnézu typických komorbidít (artériová hypertenzia, obezita, dyslipidémia, koronárna choroba, periférne artériové ochorenie, cievna mozgová príhoda alebo srdcové zlyhávanie). Z hľadiska symptomatológie vykazovali diabetici vyšší stupeň symptómov podľa klasifikácie EHRA (European Heart Rhythm Association), pričom sa menej často vyskytovali typické palpitácie, ale signifikantne častejšie bola dominantným symptómom námahová dýchavica a únava. Priemerné CHA2DS2VASc-skóre bolo u diabetikov až 5 a len minimálne percento pacientov s DM malo CHA2DS2VASc-skóre 1 (0,7 %). V porovnaní s pacientmi bez DM mali častejší výskyt perzistujúcej alebo permanentnej FP. Z hľadiska liečebne stratégie sa u pacientov s DM častejšie uplatňovala kontrola prevodu ako kontrola rytmu a menej často sa realizovala kardioverzia alebo katétrová ablácia FP. V prevencii tromboembolizmu malo vysoké percento pacientov s DM zavedenú antikoagulačnú liečbu, s čím zrejme aj súvisí porovnateľný výskyt cievnych príhod v skupine s DM aj bez DM. Nepreukázala sa rýchlejšia progresia z paroxyzmálnej do perzistujúcej/ permanentnej FP, čo je v kontraste s inými prácami, ktoré naopak tento vzťah u diabetikov potvrdili [9]. Ďalšie práce poukazujú na častejšie zlyhanie antiarytmík a vyššiu rekurenciu FP po kardioverzii ako aj katétrovej ablácii pre FP [10,11]. Uvedené klinické charakteristiky majú veľký vplyv na výber terapeutických modalít pre diabetika s FP.
Katétrová ablácia fibrilácie predsiení
Katétrová ablácia fibrilácie predsiení je štandardnou liečebnou modalitou na prevenciu recidív fibrilácie predsiení. U selektovanej skupiny pacientov s FP je pri akceptovateľne nízkom riziku komplikácií schopná zabezpečiť efektívnejšiu kontrolu rytmu v porovnaní s medikamentóznou antiarytmickou liečbou [12]. Patrí medzi rutinné výkony v kardiocentrách. Zákrok sa realizuje v analgosedácii, prípadne v celkovej anestéze. Po kanylácii femorálnych vén sa realizuje transseptálna punkcia a do ĽP sa zavádzajú 1 alebo 2 transseptálne zavádzače a následne diagnostický a ablačný katéter. V súčasnosti sú na Slovensku k dispozícii 2 varianty zákroku – kryoablácia a rádiofrekvenčná ablácia. Základom katétrovej ablácie fibrilácie predsiení je izolácia pľúcnych žíl. Pri kryoablácii sa používa špeciálny balónový katéter, ktorým sa dočasne obturuje ústie pľúcnej žily s následnou jednorázovou aplikáciou kryoablácie na ostiálno-antrálnu oblasť okolo pľúcnej žily. Pri rádiofrekvenčnej ablácii sa rádiofrekvenčná energia aplikuje fokálne a technikou bod po bode sa postupne dosiahne elektrická izolácia pľúcnych žíl. Samotná izolácia pľúcnych žíl je postačujúca pre paroxyzmálnu FP a niektoré formy perzistujúcej FP, u ktorých majú v patomechanizme dominantnú úlohu ektopické zdroje v pľúcnych žilách. Kryoablácia sa používa len na izoláciu pľúcnych žíl. Pri neparoxyzmálnych formách FP so štrukturálne remodelovanou ĽP samotná izolácia pľúcnych žíl nemusí zabezpečiť dostatočné ovplyvnenie patomechanizmu pre udržiavanie FP. Výkon sa často rozširuje o aditívne lézie v predsieňovom tkanive v rôznych variantoch (lineárna ablácia, izolácia zadnej steny, fokálna ablácia abnormálnych potenciálov, substrátová modifikácia atď). Katétrovú abláciu FP je optimálne realizovať v štádiu paroxyzmálnej FP, kedy je postačujúca čistá izolácia pľúcnych žíl a predpokladaná úspešnosť v zmysle dlhodobého udržania sinusového rytmu je okolo 80 %. Pri neparoxyzmálnych formách FP je výkon podstatne rozsiahlejší s nižšou predpokladanou úspešnosťou (50–70 %) a vyššou pravdepodobnosťou opakovania zákroku. Pacienti s FP predstavujú heterogénnu populáciu od jedincov bez definovateľného štrukturálneho ochorenia srdca s fokálnou FP z pľúcnych žíl až po závažne polymorbídnych pacientov s ťažkým kardiálnym/ extrakardiálnym postihnutím s rozsiahlou remodeláciou predsieňového tkaniva. Katétrová ablácia FP preto nemôže byť univerzálne použiteľná u každého pacienta [13]. V zásade každé závažné kardiálne alebo extrakardiálne ochorenie definuje skôr nevhodného pacienta, ktorý z katétrovej ablácie nebude profitovať a u ktorého po realizácii ablácie dôjde k veľmi skorej rekurencii FP (pa- cienti s ťažkými chlopňovými chybami, s ťažkým srdcovým zlyhávaním nesúvisiacim s FP, pľúcnou hypertenziou, ťažkou obštrukčnou chorobou pľúc, ťažkou obezitou, renálnym zlyhaním a pod). Pre indikácia na katétrovú liečbu FP u diabetikov platia rovnaké pravidlá ako u pacientov bez DM. Podľa posledných odporúčaní pre liečbu FP je katétrová ablácia FP indikovaná u symptomatických pacientov s FP ako druholíniová liečba po zlyhaní/intolerancii antiarytmík triedy I alebo III (tab. 1) [2]. Pre paroxyzmálnu FP a perzistujúcu FP bez významných rizikových faktorov pre rekurenciu je ablácia indikovaná v triede IA, pre perzistujúcu FP s rizikovými faktormi pre rekurenciu v triede IB. Aktuálne nie je katétrová ablácia FP indikovaná pre asymptomatických pacientov. Výnimkou je pacient s tachykardiou indukovanou kardiomyopatiou, kedy je ablácia indikovaná bez ohľadu na symptómy v triede IB za účelom reverzie dysfunkcie ĽK. Ako prvolíniovú liečbu je možné abláciu zvážiť u selektovaných pacientov s paroxyzmálnou FP (IIB) a perzistujúcou FP (IIC) bez rizikových faktorov rekurencie ako alternatívu antiarytmík triedy I alebo III. Aktuálne odporúčania sa v podstatne väčšej miere venujú rizikovým faktorom pre FP a asociovaným komorbiditám. Ako integrálnu súčasť liečebnej stratégie kontroly rytmu odporúčajú komplexné a systematické ovplyvnenie rizikových faktorov pre progresiu/rekurenciu FP [2]. Obzvlášť zdôrazňujú túto potrebu u pacientov plánovaných na katétrovú abláciu (obr. 3). Práve populácia pacientov s DM je charakterizovaná kumuláciou týchto faktorov (artériová hypertenzia, obezita, spánkové apnoe, srdcové zlyhávanie, fyzická inaktivita atď), ktoré komplexným mechanizmom ovplyvňujú predsieňový substrát pre FP. Odzrkadľuje sa to vo vyššom percente rekurencie FP po katétrovej ablácii, v dôsledku čoho až 40 % diabetikov po katétrovej ablácii pre FP podstupuje opakovaný výkon [11]. Obrovský význam cieleného, systematického a lekárom riadeného ovplyvnenia rizikových faktorov pre progresiu FP ako aj efektivitu katétrovej ablácie dokumentovala štúdia ARREST-AF (Aggressive Risk Factor Reduction Study for Atrial Fibrillation). Pacienti v aktívnom ramene mali až 5-krát vyššiu pravdepodobnosť dlhodobej efektivity katétrovej ablácie FP [14]. Pri zohľadnení potreby opakovanej katétrovej ablácie bolo na konci sledovaného obdobia bez FP až 87 % pacientov v aktívnom ramene. Naopak v skupine pacientov, v ktorej neprebiehalo agresívne systematické ovplyvňovania rizikových faktorov bolo na konci sledovaného obdobia v sinusovom rytme sotva 18 % pacientov [14]. Z praktického hľadiska ide predovšetkým o agresívnu redukciu hmotnosti, striktnú kontrolu artériovej hypertenzie, dyslipidémie, dlhodobú kontrolu hyperglykémie, zanechanie fajčenia, abúzu alkoholu, pravidelnú fyzickú aktivitu, diagnostiku a liečbu spánkového apnoe (schéma). Takéto cielené systematické ovplyvňovanie rizikových faktorov, komorbidít a celková zmena životného štýlu dostalo v odporúčaniach pre liečbu FP triedu odporúčania IB a odporúča sa u všetkých pacientov s FP, obzvlášť u pacientov plánovaných na katétrovú abláciu [2]. Najrozsiahlejšie údaje o efektivite a bezpečnosti katétrovej ablácie FP v populácii diabetikov z reálneho života možno dokumentovať v metaanalýze zahrňujúcej okolo 1 500 pacientov [11]. Z hľadiska bezpečnosti, výskyt komplikácií sa vyskytoval v porovnateľnej miere ako v bežnej populácii (priemerne 3,5 %) [11]. Čo sa týka efektivity, po prvej procedúre bolo v sinusovom rytme 50 % pacientov, po započítaní opakovaných procedúr sa efektivita ablácie zvýšila a až 65 % pacientov nemalo dokumentovanú FP [11]. 40 % pacientov podstúpilo opakovaný výkon pre rekurenciu FP. Ako prediktory rekurencie FP boli identifikovaný vyšší vek a vyšší bazálny HbA1c [11]. Nedostatočnú kontrolu DM ako rizikový faktor pre zlyhanie katétrovej ablácie potvrdili aj ďalšie práce [15]. Pacienti s hodnotou HbA1c > 9 % mali po ablácii dokumentovanú rekurentnú FP až v 70 %, ale pacienti s HbA1c < 7 % len v 30 % [15]. U pacientov, ktorí mali 12 mesiacov pred abláciou zhoršujúci sa trend v hodnote HbA1c recidivovala FP po ablácii až v 90 % prípadov. Naopak, ak mali pacienti 12 mesiacov pred výkonom zlepšujúci sa trend v HbA1c aspoň o 10 %, dosahovala miera rekurencie len 2 % [15]. Podobne redukcia hmotnosti aspoň o 10 % sa spája až s 6-násobnou vyššou pravdepodobnosťou dlhodobého udržania sinusového rytmu [16]. Tieto fakty sa logicky odzrkadlili aj v odporúčaniach pre liečbu FP.
Upravené podľa [2]
![Schéma | Rizikové faktory pre vznik a progresiu fibrilácie predsiení. Cielené ovplyvnenie rizikových faktorov
s preukázaným vplyvom na kontrolu rytmu a efektivitu katétrovej ablácie fibrilácie predsiení.<br>
Upravené podľa [2]](https://pl-master.mdcdn.cz/media/image_pdf/ad7d1e368ae971e52552cfb31a5fd20c.png?version=1628847150)
![Tab | Indikácie na katétrovú abláciu fibrilácie predsiení. Upravené podľa [2]](https://pl-master.mdcdn.cz/media/image_pdf/93e7cc351216b216ff0f8cf44dab1a08.png?version=1628847180)
Vlastné skúsenosti s katétrovou abláciou FP u diabetikov
V Stredoslovenskom ústave srdcových a cievnych chorôb doposiaľ podstúpilo katétrovú abláciu FP takmer 800 pacientov. V súbore 794 výkonov tvorili pacienti s DM 8,2 % (65 procedúr). Oproti pacientom bez DM sa líšili vo viacerých aspektoch. Výrazne u nich prevažovala perzistujúca forma FP (58 % vs 30 %) pred paroxyzmálnou FP (42 % vs 52 %), graf 1. Percentuálne zastúpenie opakovaných procedúr sa nelíšilo u pacientov s DM a bez DM (12 % vs 13 %). Diabetici s perzistujúcou FP mali signifi- kantne vyšší objem ĽP oproti pacientom s perzistujúcou FP bez DM (168 ml vs 152 ml), graf 2. V prípade paroxyzmálnej FP sa priemerný objem ĽP u diabetikov a nediabetikov výrazne nelíšil (112 ml vs 115 ml). Nezaznamenali sme vyšší výskyt komplikácií. V našom súbore pacientov s DM sa potvrdilo predpokladané dominantné zastúpenie neparoxyzmálnej formy FP a signifikantne väčší objem ĽP u pacientov s neparoxyzmálnou FP a DM v porovnaní s pacientmi bez DM. U všetkých pacientov s neparoxyzmálnou formou FP sme štandardne realizovali vysoko denzitné mapovanie ĽP za účelom vizualizácie substrátu pre FP a u väčšiny bola potrebná substrátová modifikácia predsieňového tkaniva nad rámec izolácie pľúcnych žíl (spravidla vo forme izolácie zadnej steny ĽP a fokálnej ablácie v oblasti septa), obr. 2. U pacientov s paroxyzmálnou FP sa výkon limituje na izoláciu pľúcnych žíl. V praxi za najvýznamnejší dôvod relatívne malého zastúpenia diabetikov v súbore pacientov po ablácii možno považovať hlavne výraznú obezitu a neschopnosť pacienta redukovať hmotnosť.


Záver a odporúčania pre prax
Katétrová ablácia FP patrí v súčasnosti medzi štandardné liečebné modality s efektivitou výrazne vyššou oproti antiarytmickej liečbe. Ideálny pacient s najvyššou pravdepodobnosťou priaznivého efektu katétrovej ablácie je neobézny pacient s paroxyzmálnou FP, bez závažných komorbidít, so štrukturálne normálnym srdcom, bez významnej dilatácie ĽP [13]. V praxi však značná časť pacientov tomuto profilu nezodpovedá. Populácia diabetikov je charakteristická častou kumuláciou rizikových faktorov a komorbidít zapríčiňujúcich vznik a progresiu FP. V liečebnej stratégii kontroly rytmu u diabetikov má katétrová ablácia svoje pevné miesto s viacerými špecifikami, ku ktorým treba prihliadať pri selekcii vhodných pacientov. Katétrovú abláciu je vhodné indikovať skôr u mladšieho pacienta, optimálne ešte v štádiu paroxyzmálnej FP s dobrou dlhodobou kontrolou diabetu a schopného aktívne spolupracovať v manažmente prítomných rizikových faktorov, obzvlášť obezity. Ako nevhodného pre katétrovú abláciu možno definovať pacienta vo vyššom veku s mnohoročnou anamnézou nedostatočne kontrolovaného DM v štádiu dlhodobo perzistujúcej FP s výrazne dilatovanou ĽP, vysokým BMI, neschopného aktívnej spolupráce v ovplyvňovaní koexistujúcich rizikových faktorov. Výsledky katétrovej ablácie FP súčasne do značnej miery závisia od úspešnosti aktívneho systematického ovplyvňovania rizikových faktorov progresie FP. Žiaľ v reálnej každodennej praxi sme často svedkami simplifikácie problematiky FP na oblasť užívania antiarytmík a antikoagulačnej liečby. Pacient sa ponecháva v pozícii pasívneho prijímateľa lekárskych odporúčaní, pričom práve pacient svojím aktívnym prístupom v modifikácii rizikových faktorov môže kľúčovým spôsobom ovplyvniť výsledky liečby. Príprava na katétrovú abláciu FP by mala začať v dostatočnom predstihu a vytvára priestor pre multidisciplinárnu starostlivosť o pacienta s DM.
MUDr Martin Škamla
www.old.suscch.eu
Doručené do redakcie 4. 3. 2021
Prijaté po recenzii 13. 4. 2021
Sources
1. Ball J, Carrington MJ, McMurray JJ et al. Atrial fibrillation: Profile and burden of an evolving epidemic in the 21st century. Int J Cardiol 2013; 167(5): 1807–1824. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ijcard.2012.12.093>.
2. Hindricks G, Potpara T, Dagres N et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J 2021; 42(5): 373–498. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehaa612>.
3. Dobbin S, Fisher M, McKay G. Management of atrial fibrillation in diabetes. Pract Diabetes 2018; 35(1): 27–31. Dostupné z DOI: <https://doi.org/10.1002/pdi.2155>.
4. Wang A, Green JB, Halperin JL et al. Atrial Fibrillation and Diabetes Mellitus: JACC Review Topic of the Week. J Am Coll Cardiol 2019; 74(8): 1107–1115. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2019.07.020>.
5. Goudis CA, Korantzopoulos P, Ntalas IV et al. Diabetes mellitus and atrial fibrillation: Pathophysiological mechanisms and potential upstream therapies. Int J Cardiol 2015; 184: 617–622. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ijcard.2015.03.052>.
6. Russo I, Frangogiannis NG. Diabetes-associated cardiac fibrosis: Cellular effectors, molecular mechanisms and therapeutic opportunities. J Mol Cell Cardiol 2016; 90: 84–93. Dostupné z DOI: <http://dx.doi.org/10.1016/j.yjmcc.2015.12.011>.
7. Kadappu KK, Boyd A, Eshoo S et al. Changes in left atrial volume in diabetes mellitus: more than diastolic dysfunction? Eur Heart J Cardiovasc Imaging 2012; 13(12): 1016–1023. Dostupné z DOI: <http://dx.doi.org/10.1093/ehjci/jes084>.
8. Echouffo-Tcheugui JB, Shrader P, Thomas L et al. Care Patterns and Outcomes in Atrial Fibrillation Patients with and without Diabetes: ORBIT- AF Registry. J Am Coll Cardiol. 2017; 70(11): 1325–1335. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2017.07.755>.
9. Sandhu RK, Conen D, Tedrow UB et al. Predisposing Factors Associated With Development of Persistent Compared With Paroxysmal Atrial Fibrillation. J Am Heart Assoc 2014; 3(3): e000916. Dostupné z DOI: <http://dx.doi.org/10.1161/JAHA.114.000916>.
10. Ebert M, Stegmann C, Kosiuk J et al. Predictors, management, and outcome of cardioversion failure early after atrial fibrillation ablation. Europace 2018; 20(9): 1428–1434. Dostupné z DOI: <http://dx.doi.org/10.1093/europace/eux327>.
11. Anselmino M, Matta M, D’Ascenzo F et al. Catheter ablation of atrial fibrillation in patients with diabetes mellitus: a systematic review and meta-analysis. Europace 2015; 17(10): 1518–25. Dostupné z DOI: <http://dx.doi.org/10.1093/europace/euv214>.
12. Calkins H, Hindricks G, Cappato R et al. 2017 HRS/EHRA/ECAS/ APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation: Executive summary. Europace 2018; 20(1): 157–208. Dostupné z DOI: <http://dx.doi.org/10.1093/europace/eux275>.
13. Škamla M, Bystriansky A. Ideálny kandidát na katétrovú liečbu fibrilácie predsiení. Kardiol Prax 2017; 15(1): 26–29.
14. Pathak RK, Middeldorp ME, Lau DH et al. Aggressive Risk Factor Reduction Study for Atrial Fibrillation and Implications for the Outcome of Ablation: The ARREST-AF Cohort Study. J Am Coll Cardiol 2014; 64(21): 2222–2231. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2014.09.028>.
15. Donnellan E, Aagaard P, Kanj M et al. Association Between Pre-Ablation Glycemic Control and Outcomes Among Patients With Diabetes Undergoing Atrial Fibrillation Ablation. JACC Clin Electrophysiol 2019; 5(8): 897–903. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacep.2019.05.018>.
16. Pathak Rajeev K, Middeldorp ME, Meredith M et al. Long-Term Effect of Goal-Directed Weight Management in an Atrial Fibrillation Cohort. J Am Coll Cardiol 2015; 65(20): 2159–2169. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2015.03.002>.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Forum Diabetologicum

Most read in this issue
- Left ventricular hypertrophy in patients with diabetes mellitus: what we don‘t think about?
- Catheter ablation of atrial fibrillation in patients with diabetes mellitus
- Alternative ways of insulin application
- Cardioprotective effect of treatment by GLP-1 analogues in the view of results of newest clinical studies
