Imunometabolický pohľad na komponenty metabolického syndrómu
Immune metabolic view on metabolic syndrome components
Metabolic syndrome is defined as cluster of independent risk factors of type 2 diabetes mellitus and cardiovascular diseases including prediabetic states associated with insulin resistance as impaired fasting glucose, impaired glucose tolerance and/or bordering increased glycosylated haemoglobin; central obesity, atherogenic dyslipidaemia with increasing of triglyceride levels and decreasing of high density lipoprotein levels and hypertension. Etiopathogenesis of metabolic syndrome implements expansion of dysfunctional adipose tissue with activation of immune system, induction of low grade inflammatory reaction and induction of insulin resistance by cytokine and lipids. Etiopathogenetic mechanisms of metabolic syndrome have primary adaptive importance in acute defence reaction against microorganism. Inflammatory induced insulin resistance in metabolic tissues is necessary for relocation of glucose to rapid proliferated immune cells utilised aerobic glycolysis such main energetic mechanism. Cytokines induced dyslipidaemia (lipaemia of sepsis) has protective value against destructive effect of endotoxin. Hypertensive sodium retention phenotype is responsible for water retention required for metabolism of proliferative immune cells and compensation of fluid losses by e.g. perspiration, vomiting and diarrhoea during infections. Their long-acting effect due to expansion of adipose tissue in obesity is associated with metabolic syndrome, type 2 diabetes mellitus and cardiovascular diseases.
Keywords:
dyslipidaemia – hypertensive sodium retention phenotype – inflammatory dysfunction of adipose tissue – insulin resistance – low grade inflammatory reaction – metabolic syndrome
Authors:
Peter Galajda; Marián Mokáň
Authors‘ workplace:
I. interná klinika JLF UK a UNM, Martin
Published in:
Forum Diab 2021; 10(3): 165-172
Category:
Overview
Metabolický syndróm sa definuje ako nenáhodný spoločný výskyt prediabetických stavov súvisiacich s inzulínovou rezistenciou, ako je hraničná glykémia nalačno, porušená glukózová tolerancia alebo hranične zvýšený glykovaný hemoglobín HbA1c, ďalej výskyt centrálnej obezity, aterogénnej dyslipidémie spojenej so zvýšením hladiny triacylglycerolov a znížením HDL-lipoproteínov s vyššou denzitou, artériovej hypertenzie a ďalších faktorov, ktoré sa podieľajú na zvýšenom riziku diabetes mellitus 2. typu a kardiovaskulárnych ochorení. V etiopatogenéze metabolického syndrómu sa uplatňuje expanzia dysfunkčného tukového tkaniva s aktiváciou imunitného systému, navodením subklinickej zápalovej reakcie a indukciou inzulínovej rezistencie zápalovými cytokínmi a lipidmi. Etiopatogenetické mechanizmy metabolického syndrómu, majú primárne adaptačný význam pri akútnej obrannej reakcii proti mikroorganizmom. Zápalom navodená inzulínová rezistencia v metabolických tkanivách je potrebná na presun glukózy k rýchlo proliferujúcim imunitným bunkám, využívajúcim aerobnú glykolýzu ako hlavný energetický mechanizmus. Cytokínmi indukovaná dyslipidémia (tzv. lipémia pri sepse) má protektívny význam pred poškodzujúcim účinkom endotoxínu. Hypertenzný, nátriumretenčný fenotyp zodpovedá za retenciu vody potrebnej pre metabolizmus proliferujúcich imunitných buniek a kompenzáciu strát tekutín napr. potením, vracaním a hnačkami pri infekciách. Pri ich dlhodobom pôsobení dôsledkom expanzie tukového tkaniva pri obezite vedú k vzniku metabolického syndrómu, diabetes mellitus 2. typu a kardiovaskulárnych ochorení.
Klíčová slova:
dyslipidémia – hypertenzný nátriumretenčný fenotyp – inzulínová rezistencia – metabolický syndróm– subklinická zápalová reakcia – zápalová dysfunkcia tukového tkaniva
Úvod
Metabolický syndróm (MS), sa definuje ako nenáhodný spoločný výskyt prediabetických stavov súvisiacich s inzulínovou rezistenciou (IR), ako je hraničná glykémia nalačno (IFG – Impaired Fasting Glucose), porušená glukózová tolerancia (IGT – Impaired Glucose Tolerance) alebo hranične zvýšený glykovaný hemoglobín HbA1c, výskyt centrálnej obezity, aterogénnej dyslipidémie spojenej so zvýšením hladiny triacylglycerolov (TAG) a znížením HDL-lipoproteínov s vyššou denzitou, artériovej hypertenzie (AH) a ďalších faktorov, ktoré sa podieľajú na zvýšenom riziku diabetes mellitus 2. typu (DM2T) a kardiovaskulárnych ochorení (KVO).
Pôvodná koncepcia MS s alternatívnym názvom syndróm inzulínovej rezistencie považovala za jeho primárny etiopatogenetický faktor IR v oblasti glukoregulácie s následnou kompenzačnou hyperinzulinémiou (HI). Výsledky ďalších štúdií však poukázali, že etiopatogenéza MS je oveľa komplexnejšia a multifaktorovou analýzou sa dokázalo, že IR a HI nevysvetľujú všetky jeho asociované abnormality. Počet primárnych etiopatogenetických faktorov sa neskôr rozšíril na dva základné, ktoré okrem IR s kompenzačnou HI zahŕňajú aj viscerálnu a ektopickú adipozitu. Zároveň sa potvrdilo, že akumulácia tukového tkaniva pôsobí nielen prostredníctvom navodenia IR, ale aj ďalšími mechanizmami nezávislými od IR. Následne bola sformulovaná etiopatogenetická triáda MS, ktorá ako tretí etiopatogenetický faktor MS zaraďuje aktiváciu systému nešpecifickej imunity s následnou chronickou subklinickou zápalovou reakciou. V súčasnosti sa preferuje tento imunometabolický pohľad na problematiku etiopatogenézy MS, na ktorého vzniku sa podieľa expanzia dysfunkčného tukového tkaniva s aktiváciou imunitného systému, navodením subklinickej zápalovej reakcie a indukciou IR zápalovými cytokínmi a lipidmi. Zároveň sa poukazuje na skutočnosť, že mechanizmy vedúce k IR, zápalovej remodelácii tukového tkaniva a subklinickej zápalovej rekcii majú adaptačný význam pri akútnej obrannej reakcii proti mikroorganizmom, ale pri dlhodobom pôsobení dôsledkom expanzie tukového tkaniva pri obezite vedú k vzniku MS [1–3].
Subklinická zápalová reakcia v patogenéze metabolického syndrómu
Subklinická zápalová reakcia je považovaná za jeden z dôležitých etiopatogenetických faktorov vzniku MS. U jedincov s MS sa zvyšujú parametre zápalovej reakcie, ako C-reaktívny proteín (CRP) v korelácii s počtom komponentov MS a úzkym vzťahom k parametrom IR, obezity a aterogénnej dyslipidémie. Multifaktorová analýza zaraďuje subklinickú zápalovú reakciu spolu s IR, centrálnou obezitou a dyslipidémiou medzi tzv. centrálny komponent MS [4–6].
Pri obezite dochádza ku chronickej aktivácii imunitného systému v úzkej korelácii s poruchami metabolizmu. Na rozdiel od klasického akútneho zápalu spojeného niekedy až s niekoľko stonásobným zvýšením zápalových parametrov a vyšším metabolickým obratom, v tomto prípade dochádza k systémovej chronickej zápalovej reakcii mierneho stupňa (low grade inflammatoty reaction) iba s menším, 4- až 6-násobným zvýšením markerov zápalu a metabolický obrat je skôr redukovaný. Kým akútna zápalová rekcia je vyvolaná reakciou imunitného systému na mikrobiálne antigény, alebo poškodenia tkaniva, v prípade subklinickej zápalovej reakcie imunitný systém odpovedá najmä na chronický nutričný signál spojený so zmenami črevného mikrobiómu a zápalovou reštrukturalizáciou tukového tkaniva. Vzhľadom na úzky a vysoko integrovaný vzťah imunitného a metabolického systému sa tento metabolický typ zápalu označuje aj ako metaflamácia [7].
Na vyvolaní subklinickej zápalovej reakcie pri MS sa podieľajú viaceré faktory, z ktorých najvýznamnejším je expandované tukové tkanivo s imunometabolickými funkciami [8,9].
Tukové tkanivo ako imunometabolický orgán
Tukové tkanivo je podľa súčasných názorov aktívny metabolický, endokrinný a imunitný orgán. Biele tukové tkanivo sa zúčastňuje obranných imunitných rekcií nielen ako zásobáreň energie, ale má aj imunomodulačné funkcie dôsledkom produkcie cytokínov a adipokínov so zápalovým, alebo protizápalovým účinkom. Jeho súčasťou sú polarizované imunitné bunky, ktoré z 80–90 % sú súčasťou vrodenej prirodzenej imunity. Tukové tkanivo je považované niektorými autormi za terciárny lymfoidný orgán [1,10–18].
V tukovom tkanive už bolo identifikovaných okolo 25 rôznych typov imunitných buniek. Zápalovo pôsobia rôzne typy tzv. M1-polarizovaných makrofágov, zápalových T-lymfocytov, zápalových prirodzených lymfoidných buniek a prirodzených T-lymfocytov, zápalových B-lymfocytov a granulocytov (neutrofily) (tab. 1). V závislosti od jednotlivých typov produkujú zápalové adipocytokíny, ako sú faktor nekrotizujúci nádory (TNFα), interleukín-1β (IL1β), IL6, interferón gama (IFNγ) a IL17, ktoré sa podieľajú na zápalom indukovanej IR [1,10–18].
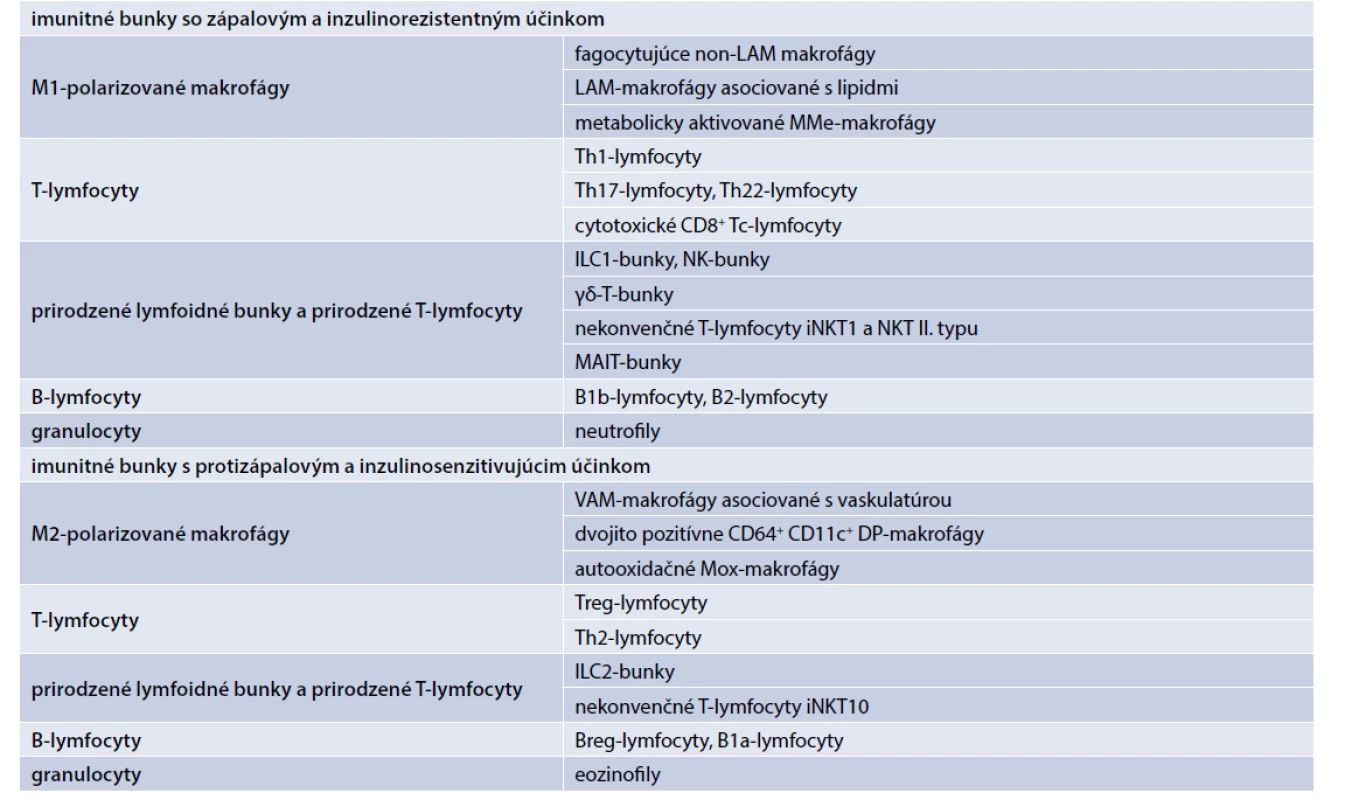
Protizápalovo v tukovom tkanive pôsobia rôzne typy tzv. M2-polarizovaných makrofágov, protizápalových T-lymfocytov, protizápalových prirodzených lymfoidných buniek a prirodzených T-lymfocytov, protizápalových B-lymfocytov a granulocytov (eozinofily) (tab. 1). V závislosti od jednotlivých bunkových línií produkujú protizápalové adipocytokíny, ako IL10, transformačný rastový faktor (TGFβ), antagonista receptora pre interleukín 1 (IL1Ra), IL4 a IL13, ktoré antagonizujú efekt zápalových cytokínov a majú inzulinosenzitivujúci účinok [1,10–18].
Okrem cytokínov sa v tukovom tkanive vytvára niekoľko stoviek ďalších biologicky aktívnych molekúl (adipokínov) a u viacerých z nich boli potvrdené aj imunomodulačné účinky. Zápalovú reakciu podporujú adipokíny ako napr. leptín, rezistín, chemerín, visfatín, retinol viažuci proteín 4 (RBP4), lipokalicín 2 a mastné kyseliny viažuci proteín 4 (FABP4), z ktorých väčšina (okrem leptínu) sa zároveň podieľa aj na navodení IR. Protizápalovo s inzulinosenzitivujúcim účinkom pôsobia adipokíny, ako napr. adiponektín a ďalší členovia CTRP (Complement factor C1q/TNF-related protein) rodiny – CTRP9, CTRP3 (CORS26), CTRP12 (adipolin); ďalej omentín/intelektín; apelín, vaspín a fibroblastový rastový faktor-21 (FGF21). Vytvára sa tak komplexná adipokínová a adipocytokínová sieť, regulujúcu vzájomné prepojenie metabolických a imunitných reakcií [1,10–18].
Tukové tkanivo je funkčne heterogénne a v organizme vytvára viacero relatívne samostatných orgánov s preferenciou metabolickej pufrovacej alebo imunometabolickej funkcie. Existuje aj špecializované tukové tkanivo s hnedým a béžovým tukom s termoregulačnou a hemodynamickou funkciou, ktorého výskyt sa potvrdil nielen u novorodencov, ale aj u dospelých (tab. 2) [1,19–22].
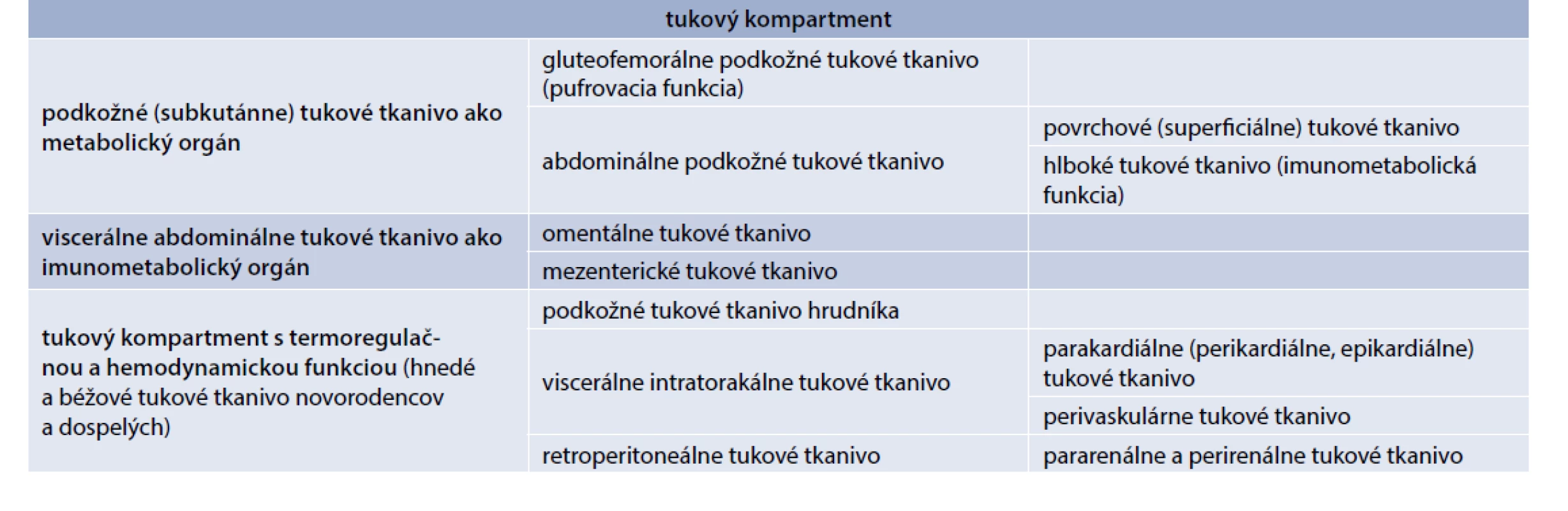
Imunometabolické funkcie plní hlavne viscerálne abdominálne tkanivo (VAT) s organizovaným imunitným tkanivom vo forme mliečnych škvŕn pri omentálnom tuku a tzv. lymfoidného tkaniva spojeného s tukom (FALC – Fat-Associated Lymphoid Cluster) v prípade mezenteriálneho tuku. Z hľadiska imunitných buniek mliečne škvrny tvoria makrofágy (50–70 %), B-lymfocyty, hlavne typu B1, produkujúcich IgM a IgA protilátky (10–30 %), T-lymfocyty (10 %), v menšom množstve aj NK-bunky. FALC obsahujú hlavne B1-lymfocyty, produkujúce IgM, T-lymfocyty prevažne Th2-typu, produkujúce IL4 a IL13, prirodzené lymfoidné bunky ILC2 typu (nuocyty) a makrofágy. VAT pri obezite sa v porovnaní s podkožným tukovým tkanivom vyznačuje vyššou infiltráciou zápalovými imunitnými bunkami, vrátane zápalových M1-makrofágov, neutrofilov, Th1- a Th17-lymfocytov, cytotoxických CD8+ Tc-lymfocytov, NK buniek a prirodzených NKT lymfocytov. Tieto špecializované súčasti tukového tkaniva sa podieľajú na obranných reakciách proti invadujúcim črevným patogénom a na navodení systémovej zápalovej reakcie a IR.
Imunometabolické funkcie má aj hlboké abdominálne tukové tkanivo s disperzným stromálnym imunitným systémom. Imunitné bunky v podkožnom tkanive na rozdiel od VAT nevytvárajú lymfoidné štruktúry, ale sú lokalizované v stróme v bezprostrednom kontakte s adipocytmi. Jeho najväčšou súčasťou sú polarizované makrofágy. V stróme podkožného tuku u štíhlych jedincov viac prevládajú bunkové populácie s protizápalovým a reparačným účinkom, ako sú M2-makrofágy, produkujúce protizápalové cytokíny IL4, IL10 a IL13, CD4+ Treg- a Th2-lymfocyty, Breg-lymfocyty a eozinofily. Nachádzajú sa tu aj menšie množstvá niektorých populácií prirodzených lymfocytov a lymfoidných buniek, ako sú ILC2-bunky, iNKT bunky a NKT-bunky typu II.
Pri obezite centrálneho typu dochádza k infiltrácii podkožného abdominálneho tuku zápalovými M1-makrofágmi, ktorá koreluje s navodením IR. Vo včasných štádiách obezity je tukové tkanivo infiltrované neutrofilmi, Th1- a Tc-lymfocytmi, produkujúcimi IFNγ, Th17-lymfocytmi, produkujúcimi IL17, B2-lymfocytmi, ILC1 a NK-bunkami a zápalovými NKT-bunkami typu II. Znižuje sa počet protizápalovo pôsobiacich eozinofilov, Treg- a Th2-lymfocytov, Breg-lymfocytov a iNKT-buniek. V neskorších štádiách dochádza k výraznej polarizácii makrofágov s prevahou zápalových M1-makrofágov a poklesom protizápalových M2-makrofágov. Dochádza tak k nepriaznivej zápalovej remodelácii a dysfunkcii tukového tkaniva [1,9–18].
Zápalový a nutričný imunometabolický signál
Subklinická zápalová reakcia pri obezite je indukovaná zvýšenou tvorbou zápalových cytokínov v expandovanom tukovom tkanive, ktoré je infiltrované zápalovými imunitnými bunkami. Túto reakciu spúšťajú zápalové a nutričné signály.
Zápalový stimul predstavuje vyššia hladina endotoxínu, dôsledkom dysfunkcie črevného mikrobiómu. V súvislosti s obezitou, MS a DM2T sa potvrdila zvýšená hladina endotoxínu, t. j. lipopolysacharidu (LPS) z gramnegatívnych črevných baktérií v korelácii s parametrami IR. Tento stav sa označuje ako metabolická endotoxémia a súvisí s črevnou dysmikróbiou a zvýšenou črevnou permeabilitou pri obezite. K zvýšenej absorpcii a vyššej postprandiálnej hladine LPS prispieva aj potrava s vysokým obsahom tukov. LPS, podobne ako peptidoglykany z grampozitívnych baktérií, je významným induktorom subklinickej zápalovej reakcie [23,24].
K stimulácii zápalu prispievajú aj nutričné stimuly ako vyššia hladina saturovaných mastných kyselín (MK), uvoľnených z tukového tkaniva zvýšenou lipolýzou, alebo prijímané vo zvýšenej miere potravou obsahujúcou vysoký obsah živočíšnych saturovaných tukov. Saturované MK pôsobia ako signálne molekuly aktivujúce imunitné bunky a podieľajú sa na zápalovej polarizácii M1-makrofágov. Saturované MK imunitný systém rozpoznáva rovnakým mechanizmom ako lipidové mikrobiálne antigény, cez tzv. Toll-like receptory (TLR).
TLR-proteíny sú rodinou membránových a intracelulárnych proteínov s významnou úlohou v indukcii vrodenej aj adaptívnej imunitnej odpovede proti mikroorganizmom. Na zápalový a nutričný signál reaguje najmä TLR4, ktorý viaže LPS z gramnegatívnych baktérií, alebo saturované MK pôsobiace ako jeho nemikrobiálne agonisty. Aktivačne pôsobia najmä kyselina laurová (C12:0), myristová (C14:0) a palmitová (C16:0). Aktivácia TLR4 zodpovedá za infiltráciu tukového tkaniva zápalovo-polarizovanými M1-makrofágmi. V adipocytoch indukuje IR, spojenú so zvýšenou lipolýzou a uvoľnením MK do cirkulácie, a tak ovplyvňuje aj systémovú periférnu IR. Experimentálne zvýšená aktivita TLR4 sa spája aj s aterogénnou dyslipidémiou. Vysoká expresia TLR4 v tukovom tkanive sa potvrdila u obéznych pacientov v súvislosti s IR Saturované MK aktivujú imunitné bunky aj cestou TLR2 a po konverzii na ceramid aj cez aktiváciu adaptérového proteínu NLRP3 inflamazómu [1,25,26].
Adaptačný význam zápalom navodenej inzulínovej rezistencie
Zložitý systém kooperácie medzi adipocytmi a imunitnými bunkami v tukovom tkanive a spojitosť so zápalom navodenou IR má predovšetkým adaptačný význam. Spojenie imunitných reakcií a metabolizmu je dôležité pre prežívanie infekcií. Súčasťou obrannej reakcie 1. typu proti intracelulárnym a extracelulárnym patogénom (nazývaná aj obranná reakcia 3. typu) je produkcia zápalových adipocytokínov a adipokínov v tukovom tkanive, ktoré sa podieľajú na navodení IR v metabolických tkanivách, potrebnej na presun glukózy k rýchlo proliferujúcim imunitným bunkám, využívajúcich aerobnú glykolýzu ako hlavný energetický mechanizmus. Táto imunometabolická reakcia je intracelulárne riadená molekulovým systémom mTOR (mammalian Target Of Rapamycin).
Na druhej strane na obrannej reakcii 2. typu proti mnohobunkovým červom, ako aj regulačných a reparačných dejoch sa tukové tkanivo zúčastňuje produkciou protizápalových adipocytokínov a adipokínov (napr. adiponektín), ktoré majú inzulinosenzitivujúci účinok a aktivujú oxidatívne systémy utilizácie glukózy a voľných MK. Tieto imunometabolické deje intracelulárne riadi AMPK (adenozínmonofosfátom aktivovaná proteínová kináza).
Pri akútnej infekcii dochádza k aktivácii systému prirodzenej imunity, ku ktorej sa po 2- až 3-dňovom období pridáva systém adaptívnej imunity, ktorého aktivita v predantibiotickom období pretrvávala 3–4 týždne po definitívne zvládnutie a ukončenie infekcie. Funkcia imunitného systému je energeticky veľmi náročná a zásoby energie v tukovom tkanive pre jeho potreby vydržali približne na 3–5 týždňov v závislosti od ich množstva a závažnosti infekcie. V porovnaní s bazálnou energetickou spotrebou 2 500 kJ/deň v mozgu, imunitný systém spotrebuje v pokoji 1 600 kJ/deň, pri miernej aktivácii 2 100 kJ/deň a pri väčšej okolo 3 000 kJ/deň. Pri závažných septických stavoch je to však až 15 000 kJ/ deň, čo je viac ako potreba svalov pri väčšej fyzickej námahe a na porovnanie sa už blíži dennej potrebe energie pri extrémnom výcviku vojakov v arktickom prostredí alebo v džungli. Kým rezidentské imunitné bunky v pokoji využívajú najmä oxidatívny metabolizmus glukózy a lipidov riadený AMPK systémom, pri proliferácii a aktivácii zápalových imunitných buniek dochádza k prepnutiu metabolizmu systémom mTOR na aeróbnu glykolýzu. K dôležitým adaptačným reakciám tak patrí zápalom navodená IR spojená s presunom glukózy pre potreby imunitného systému a zvýšené uvoľnenie MK z tukového tkaniva ako energetického substrátu pre glukoneogenézu v pečeni. Zápalové cytokíny navodením spavosti znižujú spotrebu energie v mozgu. Pokojový režim pri infekcii bez fyzickej aktivity znižuje potrebu glukózy pre kostrový sval, v ktorom sa znižuje aj jej utilizácia navodenou IR. Keďže príjem energie potravou je limitovaný absorpčnou schopnosťou gastrointestinálneho traktu na 20 000 kJ/deň a pri zápalových reakciách sa energia potrebná pre trávenie šetrí aj nechutenstvom a zníženým príjmom potravy, pre potreby zabezpečenia činnosti imunitného systému je dôležité vytvorenie dostatočných tukových zásob energie. V nasledujúcej reparačnej fáze sa energia pre imunitné bunky získava prepnutím na AMPK riadenú oxidatívnu fosforyláciu glukózy a voľných MK, energeticky menej náročným procesom. Z tohto dôvodu pre prežitie je dôležitá úzka kooperácie medzi imunitným a metabolickým systémom [1,3,27].
Dyslipidémia ako súčasť obranných reakcií
Charakteristickým prejavom MS je aterogénna dyslipidémia spojená s hypertriacylglycerolémiou (HTAG) a znížením HDL-lipoproteínov s vyššou denzitou. Dôsledkom IR v tukovom tkanive sa zvyšuje lipolýza s uvoľnením voľných MK do cirkulácie, ktoré sa transportujú do pečene. V hepatocytoch sa reesterifikujú na TAG, ktoré spolu s posttranslačnou stabilizáciou apolipoproteínu apoB zvyšujú tvorbu VLDL-častíc. Dôsledkom hepatálnej IR sa zvyšuje tvorba veľkých VLDL1-častíc, bohatých na TAG, ktoré sa v cirkulácii transformujú na malé denzné sdLDL častice. Tento proces sa zvýrazňuje pri zápalových reakciách. Zápalovými cytokínmi navodená HTAG vzniká dôsledkom zvýšenej lipolýzy tukového tkaniva, zvýšenej lipogenézy de novo a produkcie VLDL v pečeni a zníženého vychytávania VLDL-častíc z cirkulácie.
Zápalové cytokíny (TNFα, IL6, IFNγ, IL17) lipolýzou tukového tkaniva zvyšujú dostupnosť MK pre syntézu VLDL v pečeni. Zvyšujú lipolytickú aktivitu hormónsenzitívnej lipázy (HSL), hlavne stimuláciou expresie aktivačne pôsobiaceho perilipínu 1. V pečeni zápalové cytokíny zvyšujú sekréciu VLDL-lipoproteínov stimuláciou syntézy apolipoproteínu apoB a navodením hepatálnej IR. Okrem toho sa v pečeni vplyvom zápalových cytokínov a už malých dávok endotoxínu zvyšuje lipogenéza de novo spojená so syntézou MK a TAG. Cytokíny regulujú kľúčové enzýmy syntézy MK, ako sú acetyl CoA karboxyláza (ACC) a syntáza MK (FAS – Fatty Acid Synthase). Akútne pôsobia hlavne nepriamo zvýšením hladiny citrátu, alosterického aktivátora ACC, pri dlhšom pôsobení zvyšujú aj syntézu ACC a FAS. Na rozdiel od pečene v tukovom tkanive inhibujú lipogenézu de novo znížením tvorby ACC.
Pri infekciách dochádza aj k zníženému klírensu VLDL častíc, a tým k ich predĺženej dobe cirkulácie v krvnom obehu. Na zníženom vychytávaní sa podieľa hlavne menšie množstvo apoE vo VLDL časticiach, ktorého tvorba je inhibovaná zápalovými cytokínmi a endotoxínom. ApoE slúži ako ligand pre LDL-receptor a remnantný LRP-receptor, a jeho pokles v lipoproteínových časticiach znižuje ich vychytávanie v pečeni. Dôsledkom zápalom navodenej IR sa znižuje aktivita lipoproteínovej lipázy (LPL) odbúravajúcej VLDL-častice. Zápalové cytokíny na jej aktivitu v tukovom tkanive a kostrovom svalstve v akútnej fáze zápalu nevplývajú a ich účinok sa prejavuje až pri dlhšej expozícii vysokým dávkam LPS.
Zvýšená tvorba VLDL častíc je súčasťou obranných imunitných reakcií. Lipidový metabolizmus je nielen dôležitým zdrojom energie pre imunitný systém, ale aj dôležitou súčasťou obranných rekcií proti mikroorganizmom. Cytokínmi indukovaná HTAG (tzv. lipémia pri sepse) má protektívny význam pred poškodzujúcim účinkom endotoxínu. VLDL-častice sa zúčastňujú vychytávania LPS z cirkulácie a experimentálna indukcia hyperlipidémie znižuje mortalitu pri endotoxínovej sepse [1,28,29].
V prípade imunitných reakcií dochádza aj k zmene metabolizmu cholesterolu. Cholesterol je základnou substanciou potrebnou pre tvorbu bunkových membrán proliferujúcich imunitných buniek. Existujú druhové rozdiely v metabolizme cholesterolu pri zápalovej odpovedi – u primátov sa hladina celkového cholesterolu znižuje, kým u hlodavcov naopak zvyšuje dôsledkom jeho zvýšenej syntézy. Pre moduláciu zápalovej odpovede má význam najmä HDL-cholesterol (HDL-C), ktorý za fyziologických okolností pôsobí protizápalovo. Obsahuje protizápalové lipidy (napr. sfingozín 1 fosfát) a lipoproteíny, pôsobí tak imunomodulačne, vazodilatačne a znižuje aj permeabilitu endotelových buniek. HDL-častice sa tvoria v pečeni a čreve a ich funkciou z metabolického hľadiska je vychytávať nadbytočný cholesterol z periférnych buniek a mechanizmom reverzného transportu ho preniesť do pečene. Pri zápalovej reakcii dochádza k blokáde reverzného transportu cholesterolu do pečene. Zápalové cytokíny blokujú reverzný transport cholesterolu inhibíciou tvorby apoA1 v pečeni a kazetového proteínu ABCA1 v periférnych tkanivách, potrebných pre eflux cholesterolu z periférnych tkanív do nascentných prebeta- HDL-častíc. Blokádou LCAT (Lecitín-Cholesterol AcylTransferáza) a CETP (Cholesterolové Estery Transferujúceho Proteínu) inhibujú esterifikáciu cholesterolu a jeho presun do VLDL-častíc ako medzistupeň ďalšieho vychytávania cholesterolu v pečeni.
Dôsledkom zápalu sa neznižujú iba hladiny HDL-C, ale dochádza aj k remodelácii HDL-častíc. Tieto lipoproteínové častice tvoria veľmi heterogénnu populáciu z pohľadu ich veľkosti, obsahu lipidov a najmä asociovaných proteínov. Na HDL je naviazaných približne 100–200 rôznych proteínov, ktoré okrem lipidového metabolizmu regulujú aj zápalovú reakciu (antiproteázy), komplementovú kaskádu, oxidačný stres, koaguláciu a fibrinolýzu. Zúčastňujú sa aj protimikrobiálnej ochrany, ako aj reparácie poškodených tkanív. Pri akútnej zápalovej reakcii dochádza k zmene protizápalového pôsobenia HDL-častíc na zápal podporujúci účinok. Pri zápalovej reakcii sa v HDL-časticiach znižuje napr. množstvo apoA1 a antioxidačne pôsobiacej paraoxonázy, naopak sa zvyšuje napr. množstvo sérového amyloidu A (SAA), apoJ a sekrečnej fosfolipázy A2 (sPLA2) [30–33].
Hypertenzný nátriumretenčný fenotyp ako súčasť obranných reakcií
Artériová hypertenzia (AH) je nezávislým rizikovým faktorom KVO a jej prítomnosť u chorých s MS kumulatívne zvyšuje KV-riziko. AH sa považuje za fenotypový prejav MS, ale mechanizmy jej vzniku sú stále predmetom výskumu a nových zistení. Pôvodne sa zdôrazňoval najmä vplyv HI pri zachovanom nátriumretenčnom účinku inzulínu s následnou volumexpanziou a nepriamy stimulačný vplyv inzulínu na centrálny tonus sympatiku. Neskôr sa dával do popredia vplyv IR v oblasti vazodilatačného účinku inzulínu v niektorých cievnych riečiskách. Multifaktorová analýza výsledkov u rôznych populácií skôr poukazuje na primárny význam zvýšenej adipozity pri vzniku AH, kým IR a HI sú skôr modulujúcimi faktormi. Uvádza sa, že 60–70 % prípadov AH by mohlo byť vysvetlených excesom adipozity, najmä vo viscerálnej oblasti.
V rámci hypertenzného fenotypu pri obezite a MS sa uplatňujú najmä dva hlavné endokrinné systémy – zvýšená aktivita sympatikového nervového systému (SNS) a renín-angiotenzín-aldosterónového systému (RAAS), regulujúce vodno-soľný metabolizmus. Na základe efektivity liečby sa odhaduje, že aktivácia SNS a RAAS zodpovedá asi za 40 % variability vzostupu tlaku krvi v súvislosti s obezitou. Zvýšená aktivita SNS súvisí s expanziou tukového tkaniva a môže byť zapríčinená viacerými mechanizmami, vrátane stimulačného účinku adipokínov (leptín) a inzulínu pri IR. Aktivovaný SNS, najmä v oblasti renálnych sympatických nervových zakončení cestou stimulácie RAAS vyvoláva retenciu sodíka a volumexpanziu, pri dlhodobej stimulácii vedie k periférnej vazokonstrikcii.
Pri obezite dochádza k akumulácii perirenálneho tukového tkaniva, ktorého hrúbka koreluje s parametrami celkovej a centrálnej obezity. Expandovaný perirenálny tuk sa podieľa na vzniku AH pri obezite priamym mechanickým útlakom. Špecifický význam má perirenálny tuk v oblasti renálneho sínusu, ktorý obklopuje renálnu artériu a vénu, lymfatické cievy a vývodné močové cesty. V experimentálnych zvieracích modeloch sa akumulácia perirenálneho tuku spája s miernou kompresiou renálnych vén, lymfatických ciev a vývodného močového systému s následným zvýšením renálneho hydrostatického tlaku, aktiváciou RAAS a renálneho SNS, ktoré zvyšujú reabsorpciu sodíka.
V etiopatogenéze AH pri obezite a MS sa uplatňuje aj aktivácia imunitného systému. Chronická subklinická zápalová reakcia pri obezite a MS, aktivujúca nátriumretenčné systémy, vedie k retencii vody a je jedným z faktorov vzniku AH. Pri AH sa zvyšuje produkcia zápalových cytokínov, typu TNFα, IL1β a IL6. Aktiváciu zápalových imunitných buniek, produkujúcich cytokíny, podporuje angiotenzín II, aldosterón aj NaCl. Angiotenzín II podporuje zápalovú infiltráciu tukového tkaniva makrofágmi a T-lymfocytmi, pričom v nich zvyšuje produkciu zápalových cytokínov (TNFα, IL1β, IL6, IFNγ) cez AT1-receptory. Makrofágy, infiltrujúce perivaskulárne tukové tkanivo a obličky, obsahujú minerálkortikoidné MR receptory a účinkom aldosterónu sa polarizujú do zápalového M1-fenotypu.
Zápalová reakcia je úzko spojená s retenciou sodíka v obličkách. Hypertenzný nátriumretenčný fenotyp sa vyznačuje zvýšenou akumuláciou špecifických imunitných buniek v obličkách, ako sú Th17-lymfocyty, produkujúce IL17, cytotoxické CD8+ Tc-lymfocyty, NK-bunky a γδ-T-bunky, produkujúce IFNγ, a B-lymfocyty, produkujúce IgG.
Th17-lymfocyty, produkujúce IL17, sa diferencujú z Th0-lymfocytov vplyvom soli (NaCl) cestou senzorového proteínu SGK1 (Serum and Glucocortikoid-regulated Kinase 1) a aktivujú sa angiotenzínom II cez AT1-receptor. Produkovaný IL17 spolu s glukokortikoidmi a inzulínom stimulujú expresiu SGK1 v epitelových bunkách proximálneho a distálneho tubulu s následnou aktiváciou iónových kanálov a transportných systémov, podporujúcich reabsorpciu sodíka a vody, vrátane epitelového Na+ kanála ENaC, Na+/H+ výmenníka 3 (sodiumhydrogen exchanger 3) a Na+/K+ ATPázy.
CD8+-lymfocyty v obličkách sú aktivované aldosterónom cez minerálokortikoidný MR-receptor, ktorý zvyšuje produkciu IFNγ. Interakciou s bunkami distálneho tubulu zvyšujú aktivitu NaCl kotransportéru a Na+/H+ výmenníka 3, čím podporujú reabsorpciu sodíka a vody.
Produkované protilátky typu IgG B-lymfocytmi cestou špecifických Fcγ-receptorov aktivujú iónové kanály v tubuloch obličiek, zahrnutých do reabsorpcie sodíka a vody. Autoprotilátky môžu pôsobiť aj ako agonisty receptorov pre katecholamíny a angiotenzín II, preto AH má aj črty autoimunitného ochorenia.
Protektívne antihypertenzívne pôsobia protizápalové Treg-lymfocyty, produkujúce IL-10, ktorých množstvo v cirkulácii a obličkách sa pri experimentálne navodenej hypertenzii znižuje. Protizápalový cytokín IL10 blokovaním tvorby a účinku zápalových cytokínov vykazuje antihypertenzívne účinky spojené so zlepšením endotelovej dysfunkcie.
Hypertenzný fenotyp, vedúci k AH, má primárne adaptačný a protektívny význam v zápalových obranných reakciách proti invadujúcim mikrobiálnym patogénom, kde zodpovedá za retenciu sodíka a vody. Pri akútnom infekčnom zápale dochádza často k veľkým stratám tekutín, napr. dôsledkom hnačiek a vracania pri infekciách gastrointestináleneho traktu, alebo potením pri horúčke a infekciách dolných dýchacích ciest. K vysokej spotrebe vody dochádza pri metabolických reakciách zabezpečujúcich energiu pre aktivovaný imunitný systém, napr. sa spotrebujú 2 molekuly vody na uvoľnenie 1 molekuly glukózy pri glykogenolýze, 3 molekuly vody na uvoľnenie 3 molekúl MK pri lipolýze a 5 molekúl vody na utilizáciu 1 molekuly laktátu pri glukoneogenéze v pečeni. Enormné množstvo vody sa spotrebuje aj pri proliferácii imunitných buniek v rámci obranných reakcií. Pre prežitie v prirodzených podmienkach evolúcie človeka v prostredí s nízkym výskytom soli v potrave tak boli kľúčové systémy spojené s retenciou vody potrebnej pre obranné imunitné reakcie, ako aj ich úzka kooperácia s metabolickým a imunitným systémom.
Niektoré hypertenzné fenotypy majú vzťah k lepšiemu prežívaniu septických stavov a poskytujú ochranu pred septickým šokom. Spontánne hypertenzné potkany (SHR) sú rezistentné na letálny účinok podaného endotoxínu. V porovnaní s kontrolnými WKY-potkanmi akútne reagujú rovnakou hypotenziou, ktorej trvanie je však kratšie v neskoršej fáze. Na tomto fenoméne sa priaznivo podieľa množstvo protizápalových Treg-lymfocytov, remodelácia hladkej cievnej svaloviny a menšia odpoveď IL6. U ľudí zatiaľ existujú iba sporadické štúdie a túto možnosť za určitých okolností naznačujú rozdiely v prežívaní sepsy v jednotlivých populáciách. Afroameričania s vyššou prevalenciou AH v porovnaní s európskou populáciou mali nižší výskyt komplikácií sepsy 48 hod po prijatí a nižšiu hospitalizačnú mortalitu. Mortalita na infekčné choroby, pneumóniu, chrípku a v súčasnosti aj na COVID-19 je však u nich vyššia. Nátriumretenčný fenotyp, podporujúci aj zápalové reakcie, sa tak mohol selektovať ako výhoda prežitia závažných infekčných epidémií, ale v súčasnosti v prostredí s vysokým obsahom soli v potrave sa podieľa na pandemickom rozšírení AH [1,34–36].
Záver
Metabolický syndróm je komplexom rizikových faktorov vzniku DM2T a KVO. V jeho etiopatogenéze sa uplatňuje expanzia dysfunkčného tukového tkaniva s aktiváciou imunitného systému, navodením subklinickej zápalovej reakcie a indukciou IR zápalovými cytokínmi a lipidmi.
Mechanizmy, ktoré vedú k vzniku MS, majú primárne adaptačný význam pri akútnej obrannej reakcii proti mikroorganizmom v prirodzenom prostredí. Zápalom navodená IR v metabolických tkanivách je potrebná na presun glukózy k rýchlo proliferujúcim imunitným bunkám, využívajúcich aerobnú glykolýzu ako hlavný energetický mechanizmus. Cytokínmi indukovaná dyslipidémia (tzv. lipémia pri sepse) má protektívny význam pred poškodzujúcim účinkom endotoxínu. Hypertenzný, nátriumretenčný fenotyp zodpovedá za retenciu vody, potrebnej pre metabolizmus proliferujúcich imunitných buniek a kompenzáciu strát tekutín potením, vracaním a hnačkami pri infekciách.
Pri tzv. západnom štýle života spojenom s nadbytočným príjmom energie v potrave a s nízkou fyzickou aktivitou, dochádza k expanzii dysfunkčného tukového tkaniva a vzniku MS. Preto najdôležitejším preventívnym opatrením sú zásady zdravého životného štýlu s preferenciou zdravých potravín a dostatočnej fyzickej aktivity, ktoré majú priaznivý protizápalový imunomodulačný účinok na mechanizmy uplatňujúce sa pri fenotypovej expresii jednotlivých komponentov MS.
Práca bola podporená projektom v rámci operačného programu „Výskum a inovácie Európskeho fondu regionálneho rozvoja“ ITMS2014+:313011V344 „Dlhodobý strategický výskum prevencie, intervencie a mechanizmov obezity a jej komorbidít“.
prof. MUDr. Peter Galajda, CSc.
www.unm.sk
Doručené do redakcie 1. 7. 2021
Prijaté po recenzii 12. 7. 2021
Sources
1. Galajda P, Mokáň M. Metabolický syndróm, diabetes mellitus a pridružené ochorenia. Vydavateľstvo QuickPrint: Martin 2020. ISBN 978– 80–972594–6-4.
2. Zatterale F, Longo M, Naderl J et al. Chronic adipose tissue inflammation linking obesity to insulin resistance and type 2 diabetes. Frontiers Physiol 2020; 10: 1607. Dostupné z DOI: <http://dx.doi.org/10.3389/fphys.2019.01607>.
3. Pinheiro-Machado E, Gurgul-Convey E, Marzec MT. Immunometabolism in type 2 diabetes mellitus: tissue-specific interactions. Archi Med Sci 2020. Dostupné z DOI:<http://dx.doi.org/10.5114/aoms.2020.92674>.
4. Wang X, Bao W, Liu J et al. Inflammatory markers and risk of type 2 diabetes: a systematic review and meta-analysis. Diabetes Care 2013; 36(1): 166–175. Dostupné z DOI:<http://dx.doi.org/10.2337/dc12–0702>.
5. Hanley AJG, Karter AJ, Festa A et al. Factor analysis of metabolic syndrome using directly measured insulin sensitivity. The Insulin Resistance Atherosclerosis Study. Diabetes 2002; 51(8): 2642–2647. Dostupné z DOI:<http://dx.doi.org/10.2337/diabetes.51.8.2642>.
6. Duncan BB, Schmidt MI, Pankow JS et al. Low-grade systemic inflammation and the development of type 2 diabetes. Diabetes 2003; 52(7): 1799–1805. Dostupné z DOI:<http://dx.doi.org/10.2337/diabetes.52.7.1799>.
7. Hotamisligil GS. Inflammation, metaflammation and immunometabolic disorders. Nature 2017; 542(7640): 177–185. Dostupné z DOI:<http://dx.doi.org/10.1038/nature21363> .
8. Choe SS, Huh JY, Hwang IJ et al. Adipose tissue remodelling. Its role in energy metabolism and metabolic disorders. Frontiers Endocrinol (Lausanne) 2016; 7: 30. Dostupné z DOI: <http://dx.doi.org/10.3389/fendo.2016.00030>.
9. Longo M, Zatterale F, Naderi J et al. Adipose tissue dysfunction as determinant of obesity associated metabolic complications. Int J Mol Sci 2019; 20(9): 2358. Dostupné z DOI: <http://dx.doi.org/10.3390/ijms20092358>.
10. Eheim A, Medrikova D, Herzig S. Immune cells and metabolic dysfunction. Semin Immunopathol 2014; 36(1): 13–25. Dostupné z DOI: Dostupné z DOI:<http://dx.doi.org/10.1007/s00281–013–0403–7>.
11. Seijkens T, Kusters P, Chatzigeorgiou A et al. Immune cells crosstalk in obesity: A key role for costimulation? Diabetes 2014; 63(12): 3982– 3991. Dostupné z DOI:<http://dx.doi.org/10.2337/db14–0272> .
12. Chng MHY, Alonso MN, Barnse SE et al. Adaptive immunity and antigen- specific activation in obesity-associated insulin resistance. Mediators Inflamm 2015; 2015: 593075. Dostupné z DOI: <http://dx.doi.org/10.1155/2015/593075>.
13. Apostolopoulos V, de Courten M, Stojanovska L et al. The complex immunological and inflammatory network of adipose tissue in obesity. Mol Nutr Food Res 2016; 60(1): 43–57. Dostupné z DOI:<http://dx.doi.org/10.1002/mnfr.201500272> .
14. Castoldi A, de Souza CN, Câmara N et al. The macrophage switch in obesity development. Frontiers Immunol 2016; 6: 637. Dostupné z DOI: <http://dx.doi.org/10.3389/fimmu.2015.00637>.
15. Permana PA, Menge C, Reaved PD. Macrophage secreted factors induce adipocyte inflammation and insulin resistance. Biochem Biophys Res Commun 2016; 341(2): 507–514. Dostupné z DOI:<http://dx.doi.org/10.1016/j.bbrc.2006.01.012> .
16. Lackey DE, Olefsky JM. Regulation of metabolism by innate immune system. Nature Rew 2016; 12(1): 15–28. Dostupné z DOI: <http://dx.doi.org/10.1038/nrendo.2015.189>.
17. Chehimi M, Vidal H, Eljaafari A. Pathogenic role of IL-17 producing immune cells in obesity and related inflammatory diseases. J Clin Med 2017; 6(7): 68. Dostupné z DOI: <http://dx.doi.org/10.3390/jcm6070068>.
18. Saetang J, Sangkhathat S. Role of innate lymphoid cells in obesity and metabolic disease. Mol Med Reports 2018; 17(1): 1403–1412. Dostupné z DOI: <http://dx.doi.org/10.3892/mmr.2017.8038>.
19. Rafols ME. Adipose tissue: Cell heterogeneity and functional diversity. Endocrinol Nutr 2014; 61(2): 100–112. Dostupné z DOI:<http://dx.doi.org/10.1016/j.endonu.2013.03.011> .
20. Kwok KHM, Lam KSL, Xu A. Heterogeneity of white adipose tissue: molecular basis and clinical implications. Experimental & Molecular Medicine 2016; 48(3): e215. Dostupné z DOI:<http://dx.doi.org/10.1038/emm.2016.5> .
21. Dam V, Sikder T, Santosa S. From neutrophils to macrophages: differences in regional adipose tissue depots. Obesity Rew 2016: 17(1): 1–17. Dostupné z DOI:<http://dx.doi.org/10.1111/obr.12335>.
22. Carobbio S, Guenantin AC, Samuelson I et al. Brown and beige fat: From molecules to physiology and pathophysiology. Molec Cell Biol Lipids 2019: 1864: 37–50. Biochim Biophys Acta Mol Cell Biol Lipids; 1864(1): 37–50. Dostupné z DOI:<http://dx.doi.org/10.1016/j.bbalip.2018.05.013> .
23. Cani PD, Amar J, Iglesias MA et al. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes 2007; 56(7): 1761–1772. Dostupné z DOI: <http://dx.doi.org/10.2337/db06–1491>.
24. Jialal I, Rajamani U. Endotoxemia of metabolic syndrome: a pivotal mediator of meta-inflammation. Metab Syndr Relat Disord 2014; 12(9): 454–456. Dostupné z DOI:<http://dx.doi.org/10.1089/met.2014.1504>.
25. Rocha DM, Caldas AP, Oliveira LL et al. Saturated fatty acids trigger TLR4-mediated inflammatory response. Atherosclerosis 2016; 244: 211–215. Dostupné z DOI: <http://dx.doi.org/10.1016/j.atherosclerosis.2015.11.015>.
26. Rogero MM, Calder PC. Obesity, inflammation, Toll-like receptor 4 and fatty acids. Nutrients 2018; 10(4): 432. Dostupné z DOI: <http://dx.doi.org/10.3390/nu10040432>.
27. Pruimboom L, Raison CL, Muskiet FAJ. The selfish immune system when the immune system overrides the ‘selfish’ brain. J Immunol Clin Microbiol 2020; 5(1): 1–34.
28. Han R. Plasma lipoproteins are important components of the immune system. Microbiol Immunol 2010; 54(4): 246–253. Dostupné z DOI:<http://dx.doi.org/10.1111/j.1348–0421.2010.00203.x>.
29. Ramasamy I. Update to the molecular biology of dyslipidemias. Clinica Chimica Acta 2016; 454: 143–185. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cca.2015.10.033>.
30. Catapano AL, Pirillo A, Bonacina F, Norata GD. HDL in innate and adaptive immunity. Cardiovasc Res 2014; 103(3): 372–383. Dostupné z DOI: <http://dx.doi.org/10.1093/cvr/cvu150>.
31. Pirillo A, Catapano AL, Norata GD. HDL in infectious diseases and sepsis. Handb Exp Pharmacol. 2015; 224: 483–508. Dostupné z DOI:<http://dx.doi.org/10.1007/978–3-319–09665–0_15> .
32. Bonacina F, Pirillo A, Catapano AL et al. HDL in immune-inflammatory responses: Implications beyond cardiovascular diseases. Cells 2021; 10(5): 1061. Dostupné z DOI: <http://dx.doi.org/10.3390/cells10051061>.
33. Trakaki A, Marsche G. Current understanding of the immunomodulatory activities of high-density lipoproteins. Biomedicines 2021; 9(6): 587. Dostupné z DOI:<http://dx.doi.org/10.3390/biomedicines9060587>.
34. Nunes JPL. Arterial hypertension and sepsis. Rev Port Cardiol 2003; 22(11): 1375–1379.
35. Jordan J, Birkenfeld AL. Cardiometabolic crosstalk in obesity associated arterial hypertension. Rev Endocr Metab Disord 2016; 17(1):19– 28. Dostupné z DOI:<http://dx.doi.org/10.1007/s11154–016–9348–1>.
36. Migueal CD, Rudemiller NP, Abbais JM et al. Inflammation and hypertension: New undertandings and potential therapeutic targets. Curr Hypertens Rep 2016: 17(1): 507. Dostupné z DOI:<http://dx.doi.org/10.1007/s11906–014–0507-z> .
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Forum Diabetologicum

2021 Issue 3
Most read in this issue
- Perorálny semaglutid: budúcnosť agonizmu GLP1-receptorov?
- Metabolický syndróm po transplantácii obličky
- Obezita ako rizikový faktor fibrilácie predsiení a srdcového zlyhávania
- Diabetes mellitus a chronické srdcové zlyhávanie
