Lieky a dietologické prípravky pre liečbu diabetes mellitus kategorizované na Slovensku v rokoch 2013–2014 a ich indikačné obmedzenia
Autoři:
Emil Martinka
Působiště autorů:
predseda Slovenskej diabetologickej spoločnosti Slovenskej lekárskej spoločnosti
Vyšlo v časopise:
Forum Diab 2014; 3(2): 104-114
Kategorie:
Diabetológia aktuálne
„Evidence based medicine“ v koncepcii modernej slovenskej diabetológie
Diabetes mellitus je heterogénne ochorenie a dnes už poznáme viac ako 150 rôznych príčin (defektov) vedúcich v konečnom dôsledku k vzostupu hladiny glukózy v krvi (hyperglykémii). Navyše, tieto defekty sa môžu navzájom kombinovať, čím sa heterogenita ešte zvýrazňuje. To znamená (a prax to potvrdzuje), že rovnako liečba vyžaduje terapeutické ovplyvnenie ochorenia na rôznych úrovniach a obvykle je potrebná aj kombinácia viacerých mechanizmov účinkov (viacerých farmák). Súčasne ide o ochorenie, kde patogénne mechanizmy progredujú (prehlbujú sa) aj v dobe po diagnóze ochorenia, čo zas vyžaduje stupňovitú liečbu s postupnou akceleráciou a titráciou [16].
Ochorenie je závažné najmä pre komplikácie, ku ktorým vedie, v dôsledku čoho zvyšuje morbiditu a mortalitu a zhoršuje tiež kvalitu života pacientov. K dispozícii máme niekoľko štúdií zásadného významu, ktoré ukázali, že intenzívna glykemická kontrola spomaľuje a odďaľuje rozvoj komplikácií a tiež, že pre prognózu pacienta je rozhodujúca kvalita liečby počas prvých 10–15 rokov po zistení ochorenia a to tak v prípade diabetu 1. typu [1], ako aj diabetu 2. typu [14]. Naopak, ak sa v dôsledku nedostatočnej metabolickej kontroly v priebehu prvých rokov trvania ochorenia už komplikácie rozvinuli, resp. vytvoril sa solídny základ pre ich rozvoj, nepriaznivú situáciu už nedokáže zvrátiť ani neskoršia optimálna metabolická kontrola [38,39].
Hoci najznámejším prejavom diabetu (a súčasne diagnostickým kritériom) je zvýšená hladina glukózy v krvi, nie je celkom jasné, či sa súčasne jedná aj o najvýznamnejší prejav ochorenia. Obzvlášť diabetes mellitus 2. typu (DM2T) sa združuje s množstvom ďalších defektov na úrovni porúch metabolizmu tukov, krvného tlaku ale tiež dysfunkcie endotelu, prejavov chronického subklinického zápalu, oxidačným stresom a mnohými inými mechanizmami. A opäť, mnohé štúdie naznačili, že práve tieto tzv. „extraglykemické“, resp. „pleiotropné“ účinky môžu zohrávať zásadnú úlohu, napríklad pri ovplyvnení reziduálneho kardiovaskulárneho rizika, a že rovnako v prevencii mikrovaskulárnych komplikácií okrem ovplyvnenia samotnej glykémie zohrávajú úlohu aj viaceré extraglykemické faktory [19,21,22,25,28,31,36,44].
Liečba diabetu, okrem dosiahnutia požadovanej metabolickej kontroly musí byť predovšetkým bezpečná. Inými slovami, nesmie viesť k zvýšeniu morbiditno-mortalitného rizika. V poslednej dobe je zvláštna pozornosť venovaná práve kardiovaskulárnej a onkologickej bezpečnosti a regulačné orgány vyžadujú jej dokladovanie od každého nového prípravku. FDA preto požaduje, aby novšie lieky ešte pred uvedením boli testované na riziko kardiovaskulárneho ochorenia (KVO) a nesmú toto riziko zvyšovať .
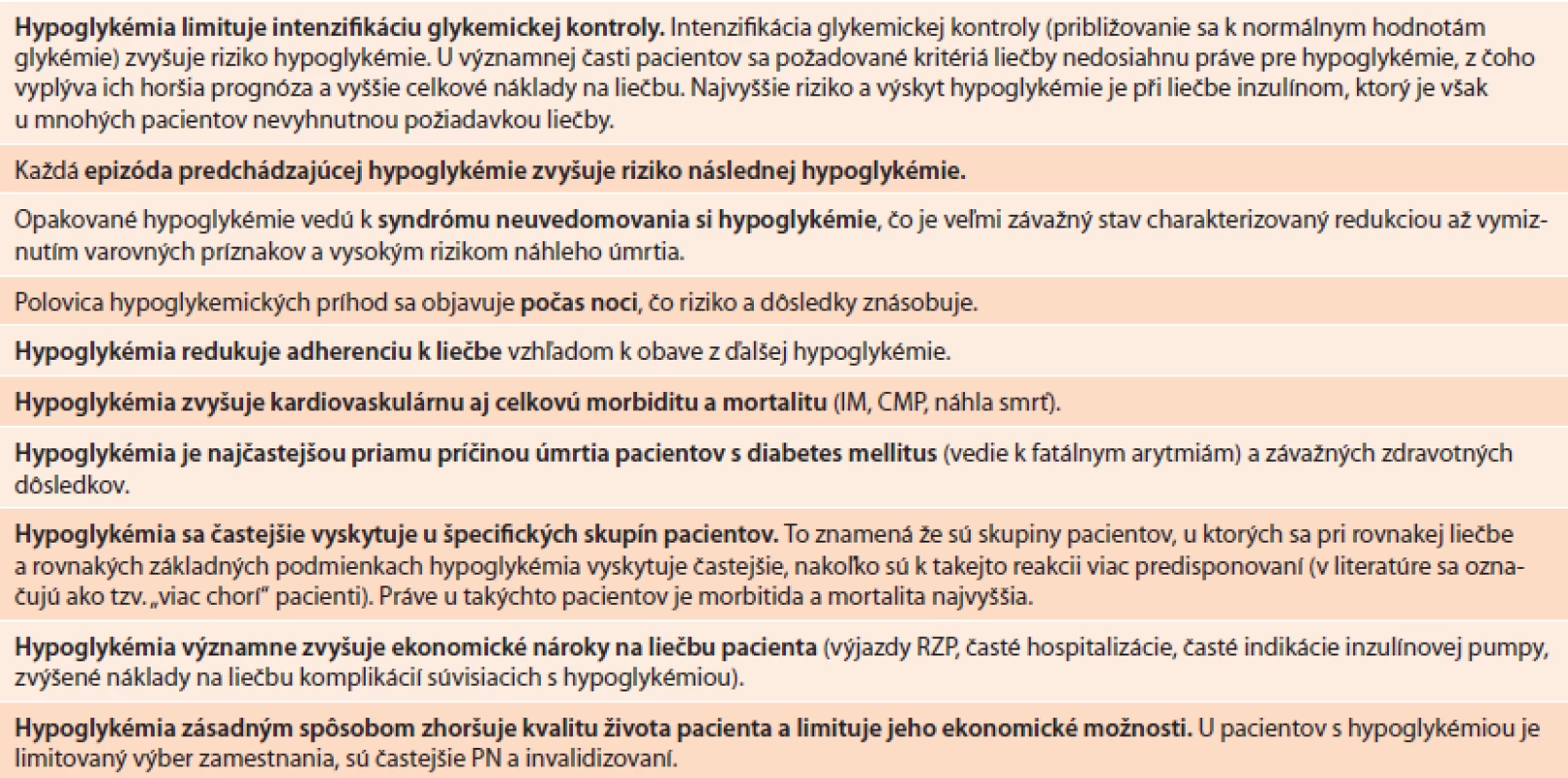
Ďalšou kľúčovou otázkou sú nežiaduce účinky liečby, medzi ktoré v prípade antidiabetických farmák patrí najmä riziko hypoglykémie a prírastku na hmotnosti. Aj tu máme k dispozícii viacero štúdií, ktoré ukázali, že aj prírastku na hmotnosti je omnoho dôležitejšie predchádzať než ju liečiť. Redukcia hmotnosti totiž síce vedie k zlepšeniu ukazovateľov parametrov rizikových faktorov, neovplyvňuje však morbiditno-mortalitné parametre (samozrejme s výnimkou extrémnej obezity liečenej bariatrickou chirurgiou) [23]. A napokon hypoglykémia. Je nielen rizikovým faktorom náhlej smrti ale tiež faktorom limitujúcim dosiahnutie adekvátnej glykemickej kontroly (tab.2). Organizmus s tendenciou hypoglykemických reakcií je obvykle ľahšie zraniteľný a práve hypoglykémia a variabilita glykémií sa v „záťažových“ situáciách, ako je napríklad infarkt myokardu, prejavuje už v najvčasnejších štádiách, resp. ich ovplyvnenie v týchto štádiách má pre pacienta (paradoxne?) najväčší benefit [40]. Ako veľmi dôležitý sa ukazuje aj pleiotropný extraglykemický účinok a možnosť vzájomnej, čo najširšej kombinácie jednotlivých farmák v celej časovej osi ochorenia.
Čo z týchto vyššie uvedených faktov vyplýva pre našu každodennú prax? Predovšetkým potreba včasnej diagnózy ochorenia a včasnej adekvátnej liečby. Teda aby bol pacient od začiatku vedený odborníkom – diabetológom. Ďalšou potrebou je, aby diabetológ mal k dispozícii farmaká pôsobiace na rôznych úrovniach a mal možnosť ich reálne použiť (inými slovami, musia to umožňovať aj znenia indikačných obmedzení) už vo včasných štádiách liečby, kedy môžu poskytnúť najväčší cost/benefit efektívny prínos. Tieto a mnohé ďalšie fakty zdôrazňuje aj Slovenská diabetologická spoločnosť vo svojich vyjadreniach ku kategorizácii a tvorbe indikačných obmedzení (tab. 1).

„Evidence based medicine“ v liečbe diabetes mellitus 2. typu prostredníctvom kategorizácie a indikačných obmedzení
Za základnú a najvýznamnejšiu podmienku správnej liečby ochorenia diabetes mellitus 2. typu (DM2T) od samého začiatku ochorenia sa trvale považuje racionalizácia životného štýlu, čo zahŕňa najmä racionálnu výživu s výberom zdravých zdrojov živín, primeranú fyzickú aktivitu a prevenciu/redukciu telesnej hmotnosti, pokiaľ je zvýšená. Dosahuje sa predovšetkým edukáciou pacienta a potenciál takejto liečby je porovnateľný s výsledkami farmakologickej liečby. Cieľom liečby v tomto období je podľa možností normalizácia glykémií.
Ak samotná racionalizácia nepostačuje, je nutné začať s farmakoterapiou.
V súčasnej dobe sa za zlatý štandard iniciácie farmakologickej liečby DM2T považuje liečba metformínom [16]. Výhody lieku spočívajú nielen v signifikantnom účinku na glykémiu, ale aj v širokom spektre extraglykemických účinkov. Hlavným dôvodom, pre ktorý je metformín dlhodobo považovaný za zlatý štandard liečby, je okrem efektívnej kontroly glykémie najmä nízke riziko hypoglykémie, hmotnostná neutralita a potenciálny kardiovaskulárny benefit [14,16]. Pomerne veľký podiel pacientov však tento liek netoleruje v dôsledku gastrointestinálnych nežiaducich účinkov (nauzea, hnačka) alebo je kontraindikovaný (pacienti so zlyhávaním srdca, renálnou či hepatálnou insuficienciou, respiračnou insuficienciou či akútnou alebo chronickou acidózou). Podľa viacerých údajov sa podiel takýchto pacientov pohybuje v rozsahu 15–20% [4].
Alternatívou liečby bola donedávna obvykle sulfonylurea alebo glitazóny. V súčasnej dobe sa však tieto prípravky (s výnimkou gliklazidu) využívajú čoraz menej a to pre neistotu ich bezpečnosti. V prípade sulfonylurey je hlavnou limitáciou zvýšené riziko hypoglykémie a prírastok na hmotnosti. Tieto limitácie sú najevidentnejšie práve u pacientov vo včasných štádiách, t.j. u pacientov len s mierne vyšším HbA1c v rozsahu 7–8%, u ktorých je žiaduca normalizácia glykemickej kontroly, a u starších pacientov, ktorí sú v riziku častejších a ťažších hypoglykémií s potenciálne závažnejšími dôsledkami [4]. Okrem toho, prípravkom sulfonylurey (s výnimkou gliklazidu) sa pripisuje aj zvýšená kardiovaskulárna morbidita a mortalita [18] a v dôsledku nefyziologickej stimulácie sekrécie inzulínu aj rýchlejšie rozvinutie sa dysfunkcie sekrécie inzulínu. V prípade glitazonov (v súčasnej dobe zostal na trhu už iba pioglitazón) je limitácia ešte výraznejšia v dôsledku neistoty o bezpečnosti aj tohto farmaka z hľadiska rizika retencie tekutín, srdcového zlyhávania, fraktúr či rakoviny močového mechúra [4,16].
Ako výhodná alternatíva metformínu v monoterapii sa ukazuje a čoraz viac presadzuje liečba pomocou inhibítorov dipeptidylpeptidázy 4, čiže gliptínmi [4,16]. Veľmi podobné úvahy týkajúce sa efektivity, bezpečnosti, rizika hypoglykémie a prírastku na hmotnosti sa vynárajú aj pri intenzifikácii liečby v prípade, že samotná monoterapia metformínom postupom času stratila schopnosť udržať adekvátnu úroveň glykemickej kontroly a do kombinácie je potrebné priradiť ďalšie antidiabetikum. Aj tu sa ako výhodnejšia alternatíva sulfonylurey jasne presadzuje liečba akcentáciou inkretínového účinku prostredníctvom gliptínov, ako sú linagliptín, saxagliptín, sitagliptín, vildagliptín alebo agonistov GLP1-receptorov (exenatid, liraglutid, lixisenatid). O gliptínoch bolo v našej literatúre popísané už mnoho článkov. V skratke, jedná sa o skupinu farmák, ktoré nielenže významne rozširujú doterajšie možnosti liečby tým, že dopĺňajú účinok na viaceré „terapeutické terče“, ktoré donedávna neboli pokryté účinkom žiadnych iných farmák, ale prinášajú aj úplne nové perspektívy. Liečba pomocou gliptínov je založená na fyziologických mechanizmoch a ich hlavná pridaná hodnota spočíva v efektívnej glykemickej kontrole, ktorá je dlhodobá. Tá sa môže uplatniť tak v iniciálnej liečbe alebo aditívnym efektom pri rôznych terapeutických kombináciách (dvojkombinácia, trojkombinácia perorálnymi antidiabetikami), vrátane kombinácie s inzulínom. Aj keď v absolútnych hodnotách sa môže zdať pokles HbA1c pri liečbe gliptínmi relatívne nízky (0,6%-1,1%) v porovnaní s inými prípravkami tento pokles sa uplatňuje vo všetkých stupňoch liečby a kombináciách s inými prípravkami. Navyše efekt sa uplatňuje iba v prípade vzostupu glykémie (glukózodependentný účinok), čo znamená, že riziko hypoglykémie je pri liečbe gliptínmi minimálne. Inhibítory DPP4 účinkujú mechanizmom vzostupu hladín prirodzených inkretínov GLP1 (glucagon like peptide 1) a GIP (gastric inhibitory polypeptide) tým, že zabraňujú ich štiepeniu dipeptidylpeptidázou 4 (DPP4). Oba tieto hormóny stimulujú sekréciu inzulínu. GLP1 okrem toho suprimuje sekréciu glukagónu, čo je hlavný hormón glukoneogenézy (účinok na pokles glykémie je teda duálny). GIP však v prípade nižších hladín glykémie glukagón stimuluje, čím bráni nadmernému poklesu glykémie [4]. Medzi extraglykemické účinky patrí priaznivý efekt na krvné tuky, krvný tlak, telesnú hmotnosť, spomalenie vyprázdňovania žalúdka s dlhším pocitom nasýtenia, priaznivý efekt na chronický subklinický vaskulárny a adipogénny zápal a ďalšie [6,21,25]. V posledných rokoch sa tieto pleiotropné účinky veľmi intezívne skúmajú s pozoruhodnými pozorovaniami, ktoré môžu mať kardioprotektívny účinok najmä v prípade akútnych kardiovaskulárnych komplikácií. Výsledky niekoľkých štúdií dokumentovali, že podanie natívnej molekuly GLP1 alebo agonistov GLP1-receptorov v akútnej fáze infarktu myokardu zlepšuje metabolizmus ischemických buniek, bráni reperfúznemu poškodeniu, prispieva k zmenšeniu rozsahu ložiska infarktu, má antiarytmický účinok a zlepšuje funkciu ľavej komory [21, 22,28]. Viaceré z týchto účinkov boli opísané aj pri gliptínoch či už v experimente na zvierati [19,36,43] alebo u človeka [6,19,31]. Gliptíny okrem GLP1 a GIP ovplyvňujú aj ďalšie substráty, spomedzi ktorých v problematike kardiovaskulárneho benefitu kľúčovú úlohu zohráva tzv. SDF1α (stromal cell-derived factor 1 alpha), ktorý do miesta ischémie priťahuje multipotentné, endotelové progenitorové bunky, čím podporuje postischemickú angiogenézu. V experimentálne navodenom infarkte myokardu u myší viedlo súčasné podávanie DPP4 a GCSF (stimuluje mobilizáciu kmeňových buniek) k nasmerovaniu cirkulujúcich CXCR4+ kmeňových buniek do myokardu, redukcii remodelácie myokardu a zlepšeniu výkonu myokardu a jeho prežívania [36,44]. Gliptíny okrem benefitu pri akútnych kardiovaskulárnych príhodách však prejavujú aj neutrálny až potenciálny dlhodobý morbiditno-mortalitný kardiovaskulárny benefit, na čo poukázali viaceré registrové štúdie a metaanalýzy štúdií s gliptínmi [7,17,19,34]. Či sa tieto pozorovania potvrdia a uplatnia aj v klinickej praxi, ukážu výsledky viacerých „megaštúdií“, ako sú napríklad TECOS či CAROLINA.
Nové znenia indikačných obmedzení pre gliptíny a fixné kombinácie gliptínov s metformínom
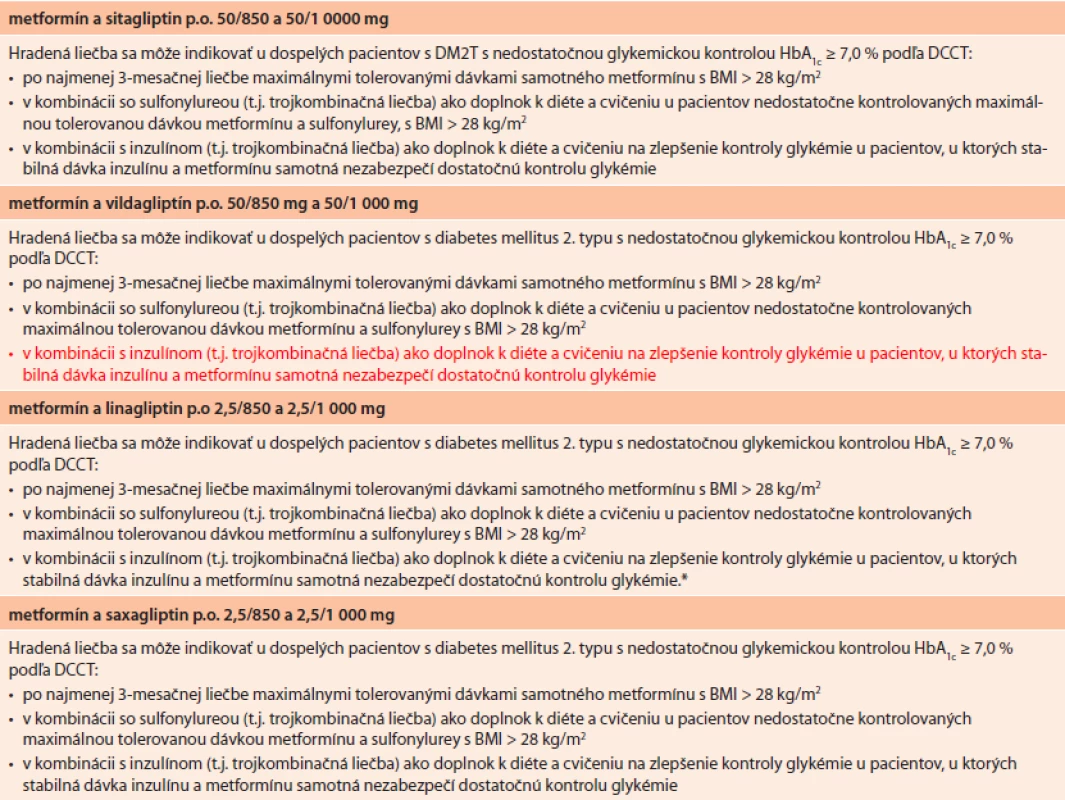
Od 1. 7. 2013 na Slovensku platia nové indikačné obmedzenia pre liečbu pomocou gliptínov (tab. 3). Nové znenie vzišlo z konsenzu rokovania odbornej pracovnej skupiny pre antidiabetiká, zástupcov ministerstva zdravotníctva a zdravotných poisťovní na podnet, ktorý iniciovala Slovenská diabetologická spoločnosť na základe poznatkov „medicíny založenej na dôkazoch“ (EBM) a aktualizácie SPC jednotlivých gliptínov. Prečo a v čom bolo potrebné dosiahnuť zmeny indikačných obmedzení? V prípade vildagliptínu, linagliptínu a saxagliptínu sa primárne jednalo o rozšírenie jestvujúcich indikácií a kombinácií v zmysle aktuálnych SPC týchto molekúl zhruba na úroveň sitagliptínu (tab. 3). Okrem rozšírenia indikačných možností sa však konsenzus dosiahol aj v štyroch ďalších dôležitých bodoch. Skrátila sa požiadavka na dĺžku trvania neuspokojivej monoterapie metformínom (ako podmienka pridania gliptínu) zo 6 na 3 mesiace. Upravila sa podmienka minimálnej hladiny HbA1c na hodnotu 7 %. Znížila sa podmienka hodnoty BMI z 30 na 28 kg.m-2. Rozšírilo sa znenie indikácie pre kombináciu gliptínov s inzulínom aj pri súčasnej liečbe metformínom (teda nielen v prípade intolerancie alebo kontrandikácie metformínu pri liečbe inzulínom).
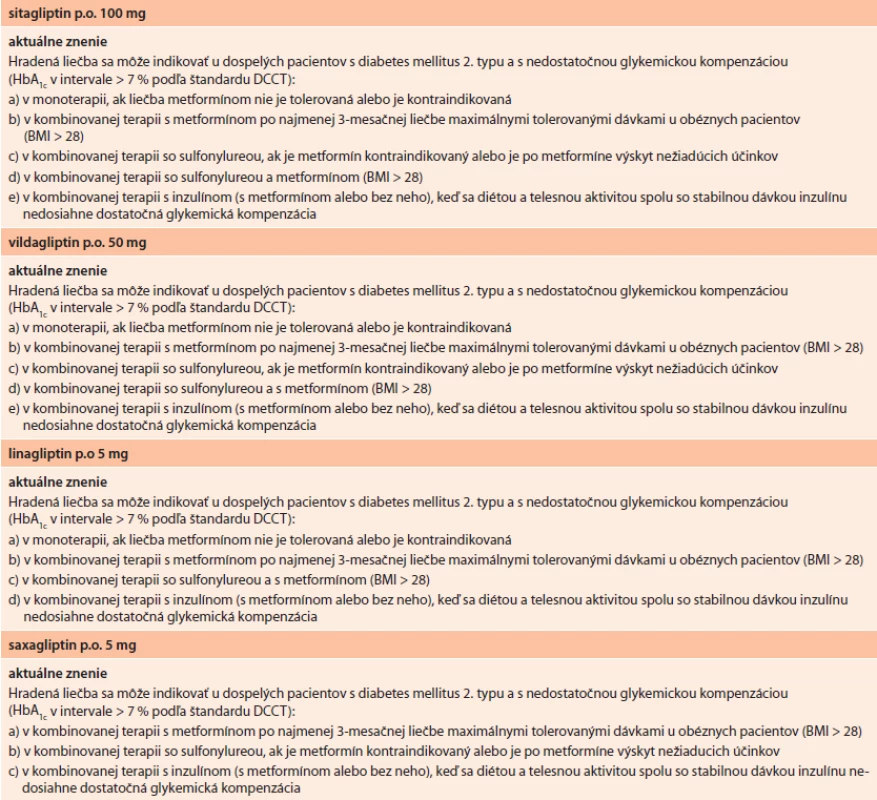
Ako nedávno ukázala štúdia Look AHEAD [23], nárastu hmotnosti je nutné predchádzať, a teda prednostne voliť farmaká, ktoré nevedú k prírastku na hmotnosti. Takými farmakami sú práve gliptíny. Neskoršia redukcia hmotnosti (pokiaľ sa dosiahne) síce vedie k vylepšeniu rizikových faktorov (tlak, lipidy, glykémia), neprináša však zníženie kardiovaskulárneho rizika, ktoré je hlavnou príčinou morbidity a mortality pacientov s DM2T. Podmieňovanie indikácie vysokým BMI teda nielenže nemalo medicínske zdôvodnenie, ale práve naopak, bolo v rozpore so súčasnými poznatkami. Redukcia podmienkovej hodnoty BMI priniesla nielen medicínsky benefit pre pacienta, ale aj reálny predpoklad redukcie nákladov v dôsledku prevencie dôsledkov obezity. Rovnako posunutie podmienky indikácie gliptínov pre trvanie neuspokojivej kompenzacie pri monoterapii metformínom z hranice 6 mesiacov na 3 mesiace prináša benefit pre pacienta. Vyčkávanie na akcentáciu liečby pri nedostatočnej glykemickej kompenzácii sa totiž považuje za chybu postupu. Napokon, liečba metformínom prináša celý rad priaznivých účinkov a obvykle vedie aj k redukcii potreby dávok inzulínu až o 10–30 %, resp. približne 19 U/deň, čo znamená úsporu liečby inzulínom. Keďže metformín predstavuje základnú súčasť liečby diabetika 2. typu, mala by byť táto ponechaná trvalo (vrátane pri liečbe inzulínom) a nemala by byť prekážkou pre pridanie gliptínu. Aktuálne indikačné obmedzenia pre gliptíny a ich fixné kombinácie s metformínom sú uvedené v tab. 3 a tab. 4. Možno konštatovať, že tieto indikačné obmedzenia nám umožňujú postupovať v súlade so štandardizovaným odporúčaním ADA/EASD pre liečbu DM2T [16].
Kategorizácia lixisenatidu – nového agonistu GLP1-receptorov s akcentovaným účinkom na postprandiálnu glykémiu
Nový agonista GLP1-receptorov s účinnou látkou lixisenatid predstavuje významné rozšírenie možností liečby založenej na báze inkretínového účinku (tzv. agonistov GLP1-receptorov), ktorá je v súčasnej dobe považovaná za najmodernejší trend liečby DM2T, čo odráža aj jej postavenie v referenčných algoritmoch. Hlavnými benefitmi liečby je okrem účinku na redukciu glykémie a HbA1c predovšetkým fakt, že tento sa dosahuje pri nízkom riziku hypoglykémie, nevedie k prírastku na hmotnosti (naopak k jej redukcii), ako aj relatívne široký benefit na extraglykemické parametre (znižuje tlak krvi, vylepšuje spektrum krvných tukov, prejavuje priaznivý vplyv na viaceré pleiotropné parametre) a kardiovaskulárna bezpečnosť s reálnym predpokladom zlepšenia prognózy pacienta vrátane kardiovaskulárnej morbidity a mortality, ktorá je najčastejšou príčinou úmrtí pacientov s DM2T. V skupine agonistov GLP1-receptorov tak máme v súčasnej dobe zakategorizované 3 účinné látky (exenatid, liraglutid, lixisenatid). Vychádzajúc z relevantných literárnych údajov je zrejmé, že lixisenatid prináša porovnateľný efekt na pokles HbA1c a ostatné relevantné glykemické ako aj extraglykemické parametre, podobne ako je tomu pri dvoch predošlých účinných látkach. Ukazuje sa však, že medzi jednotlivými zástupcami jestvujú určité odlišnosti v trvaní účinku (krátkoúčinkujúce a dlhoúčinkujúce) a v pomere účinku na preprandiálnu a postprandiálnu glykémiu. V tomto zmysle, v prípade lixisenatidu možno za „pridanú“ hodnotu považovať akcentovaný efekt na postprandiálnu glykémiu, obzvlášť po raňajkách, čo je v praxi najčastejšia a súčasne najťažšie kontrolovateľná postprandiálna hyperglykémia v glykemických profiloch väčšiny pacientov. Súčasne sa jedná o jediného krátkoúčinkujúceho agonistu GLP1-receptoru GLP1-receptor agonista na trhu, ktorý postačuje podať 1krát denne. S farmakokinetickými vlastnosťami môže súvisieť aj nižšie riziko hypoglykémie a výskytu nežiaducich gastrointestinálnych prejavov, ako dokumentovali niektoré štúdie. Je teda reálny predpoklad, že v rámci indikovaných pacientov v jednotlivých prípadoch pacientov vybratých podľa dominacie problému glykemickej odozvy (dominancia preprandiálnej alebo postprandiálnej hyperglykémie) prinesie lixisenatid v individuálnych prípadoch významné zefektívnenie výsledkov liečby, než poskytovali doterajšie možnosti, pri rovnakých indikačných obmedzeniach.

Kategorizácia prvého zástupcu inhibítorov SGLT2-transportéra (gliflozínov) dapagliflozínu
Gliflozíny sú novou skupinou perorálnych antidiabetík (tabletiek pre liečbu diabetes mellitus 2. typu). Podľa účinku sa označujú aj ako inhibítory transportéra SGLT2. Tento transportér sa nachádza prakticky výlučne v proximálnom tubule obličiek (t.j. na začiatku odvodných kanálikov) a za fyziologických okolností zabezpečuje > 90% spätné vstrebávanie glukózy z primárneho moču, ktorý prechádza systémom kanálikov obličiek pred jeho vylúčením z organizmu. Inhibícia SGLT2-transportéra teda vedie k redukcii spätného vstrebávania glukózy, ktorá sa tak vylučuje do konečného moču. Týmto mechanizmom dochádza aj k poklesu glykémie. Gliflozíny tak poskytujú nový a jedinečný účinok, ktorý je úplne odlišný od jestvujúcich farmák (orálnych antidiabetík, agonistov GLP1-agonistov, či inzulínu). Zjednodušene povedané, gliflozíny vypúšťajú z organizmu glukózu do moču, ak je jej hladina zvýšená. Efekt sa uplatňuje tak v monoterapii (teda keď sa v liečbe diabetu používa iba ako samostatný liek) ako aj pri vzájomnej kombinácii s inými perorálnymi antidiabetikami alebo s inzulínom (vtedy sa účinok navzájom posilňuje). Spôsob, akým gliflozíny účinkujú sa ukázal nielen ako efektívny ale aj bezpečný. Navyše okrem úpravy glykémie vedie zvýšené vylučovanie glukózy do moču tiež k redukcii telesnej hmotnosti, poklesu krvného tlaku a nižšie je aj riziko hypoglykémie (v porovnaní so sulfonylureou). Rovnako, efekt na hmotnosť a krvný tlak sa pozoruje tak pri monoterapii, ako aj kombinovanej liečbe.
Na Slovensku bol nedávno kategorizovaný prvý zástupca z tejto skupiny s účinnou látkou dapagliflozin, ktorý sa zanedlho objaví aj v lekárňach. Jedná sa o liek pre liečbu diabetes mellitus 2. typu ktorého indikácia bude obmedzená akceptovateľným indikačným obmedzením.

Kategorizácia prípravku Glucerna Triple Care. Dietologický prípravok s terapeutickým efektom
Racionálna výživa je základnou požiadavkou pri liečbe pacienta s diabetes mellitus. Podľa rôznych literárnych zdrojov sa výživa spolu s adekvátnou pohybovou aktivitou podieľa na výsledku metabolickej kontroly až v 50 %. Terapeutický efekt nefarmakologickej liečby (najmä fyzická aktivita a správna výživa) je v mnohých ohľadoch porovnateľný s efektom farmák (liekov) na liečbu diabetes mellitus. Je to však súčasne najnáročnejšia a pre pacienta najťažšie realizovateľná súčasť liečby (v porovnaní s užívaním liekov alebo podávaním inzulínu) pretože vyžaduje čas, vedomosti a spoluprácu, čo býva u mnohých pacientov problematické (v dôsledku zamestnania, vedomostnej úrovne, sociálneho postavenia a pod). Okrem toho, možnosti štandardnej dietoterapie sú v mnohých prípadoch prirodzene limitované.

Aj z tohto dôvodu boli vyvinuté tzv. diabetes špecifické nutričné formuly (DŠNF), ktoré dokážu napomôcť k riešeniu viacerých situácií v klinickej praxi, ako je rezistentná postprandiálna hyperglykémia (ťažko zvládnuteľná hyperglykémia po jedle), variabilita glykémií (nadmerné kolísanie a menlivosť glykémií), častý výskyt hypoglykémie a pod. Efekt DŠNF sa dosahuje na princípe ekvikalorickej náhrady časti (alebo celého) bežného jedla, najčastejšie na raňajky, u ktorých býva problematika rezistentnej postprandiálnej hyperglykémie najvýraznejšia. Inými slovami prípravkom sa nahrádza časť, alebo celé príslušné jedlo tak, aby prípravok nahradil rovnaký počet kalórií, ktorý je obsiahnutý v príslušnom jedle. Časť energie (kalórií) zo sacharidov v potrave sa nahrádza rovnakým množstvom kalórií z mononenasýtených mastných kyselín, ktorých najznámejším zdrojom je olivový olej. Je známe, že mononenasýtené mastné kyseliny (a olivový olej) poskytujú celý rad priaznivých účinkov na organizmus. Ich dostatočný príjem znižuje riziko srdcovocievnych komplikácií a naopak, ich nedostatok zhoršuje citlivosť na inzulín a pod). Okrem redukcie vzostupu glykémie teda poskytujú aj ďalšie benefity.
Medzi najznámejšie prípravky DŠNF patrí Glucerna. V klinických štúdiách Glucerna viedla k nižšej glykemickej odozve a významnému poklesu postprandiálnej glykémie, k významnému poklesu HbA1c, telesnej hmotnosti, úprave hladín krvných tukov (vzostup „dobrého“ HDL-cholesterolu, pokles triglyceridov) a ďalším benefitom. DŠNF, ako je Glucerna, sú v dnešnej dobe už aj súčasťou medzinárodných terapeutických algoritmov liečby diabetes mellitus. Na Slovensku bol nedávno zakategorizovaný prípravok Glucerna Triple Care, ktorý bude možné využívať aj pri vyššie uvedených stavoch s cieľom dosiahnuť pokles HbA1c, telesnej hmotnosti, krvného tlaku, zlepšeniu profilu krvných tukov. Prípravok bude hradený zo zdravotného poistenia v počte 2 kusy/deň, čo v priemere postačuje na pokrytie približne jedného kompletného jedla. Jeho použitie usmerňuje indikačné obmedzenie (viď nižšie). Prípravok je určený tak pre pacientov s diabetes mellitus 1. typu ako aj 2. typu
Nový bazálny analóg inzulínu – inzulín degludek
Inzulín degludek je nový bazálny inzulín s významne predĺženým a vyrovnaným účinkom, ktorý vďaka svojim farmakokinetickým a farmakodynamickým vlastnostiam predstavuje signifikantne nižšie riziko hypoglykémie (obzvlášť nočnej hypoglykémie) a nižšiu variabilitu glykémií než donedávna najmodernejšie bazálne analógy inzulínu (inzulín glargin a inzulín detemir). Dĺžka účinku inzulínu degludek presahuje 42 hodín (pri bazálnych analógoch glargin a detemir do 24 hodín), čo v klinickej praxi znamená, že pri dennom podávaní dochádza k žiaducemu prekrývaniu sa účinku, a vytvára sa tak určitá vyrovnaná hladina inzulínu (steady-state) bez zjavných maxím a miním účinku. Práve minimá a maximá účinku totiž predstavujú zásadný nedostatok pri všetkých doteraz používaných bazálnych inzulínoch vrátane analógov, nakoľko obdobia maxím zvyšujú riziko hypoglykémie a obdobia miním zasa zvyšujú výskyt hyperglykémie. Hypoglykémia je nepochybne jedným z najvýznamnejších nežiaducich účinkov liečby diabetes mellitus a jej riziko narastá so snahou a približovaním sa k normálnym hodnotám glykémií (tab. 2). Riziko hypoglykémie je prirodzene najvyššie pri liečbe inzulínom. Hoci sme od čias objavenia inzulínu a vývoja prípravkov pre substitúciu jeho bazálnej sekrécie prešli významným vývojom, ktorý viedol aj k redukcii rizika hypoglykémie (významne nižšie riziko hypoglykémie sa v porovnaní s NPH-inzulínmi dosiahlo pri bazálnych analógoch inzulínu ako sú inzulín detemir a inzulín glargín), predsa len, toto riziko pretrváva. Dôsledky hypoglykémie sú rôznorodé (tab. 2). Okrem skutočnosti, že hypoglykémia predstavuje najvýznamnejší faktor limitujúci intenzifikáciu glykemickej kontroly (t.j. približovanie sa k ideálnym hodnotám glykémií), združuje sa tiež so zvýšenou celkovou aj kardiovaskulárnou morbiditou a mortalitou a predstavuje aj marker identifikujúci zvýšene rizikových pacientov (pacienti, u ktorých sa hypoglykémie objavujú často, obvykle majú okrem cukrovky aj iné závažné ochorenia). Hoci účinok bazálnych analógov inzulínu (detemir, glargin) je významne dlhší (približne 16–24 hodín) a významne vyrovnanejší než pri NPH-inzulínoch, predsa sa len objavujú určité maximá a minimá účinku, čo v konečnom dôsledku u mnohých pacientov vedie ku kolísaniu glykémií, vrátane výskytu hypoglykémií. Odborná verejnosť preto veľmi oceňuje, že sa na slovenský trh dostáva nový bazálny analóg inzulínu, ktorý na rozdiel od tých, ktoré máme k dispozícii v súčasnej dobe, účinkuje až viac ako 40 hodín a jeho účinok je ešte vyrovnanejší. To znamená že pri podávaní v denných intervaloch sa rýchlo vytvára tzv. steady state“, ktorý prakticky eliminuje maximá a minimá a poskytuje dlhodobo vyrovnaný efekt. Vďaka uvedeným vlastnostiam, ktoré sa dosahujú vďaka špeciálnej technológii výroby, je riziko hypoglykémie pri inzulíne degludek významne nižšie, a to nielen v celkovom počte hypoglyémií, ale predovšetkým vo výskyte nočných hypoglykémií. To je obzvlášť dôležité, nakoľko nočné hypoglykémie môžu mať pre pacienta omnoho vážnejšie dôsledky, než denné hypoglykémie. Inzulín degludek je možné podávať v ktorúkoľvek dobu dňa a očakáva sa tiež nižšia spotreba inzulínu. Je určený tak pre pacientov s diabetes mellitus 1. typu ako aj 2. typu.

Ďalšou významnou farmakokinetickou a glukodynamickou prednosťou inzulínu degludek je vyrovnanejšie vstrebávanie inzulínu z miesta vpichu, čo zabezpečuje vyrovnaný účinok a nižšiu vnútrodennú a medzidennú varaibilitu účinku a následne glykémií. Obdobne problematika variability glykémií (t.j. hodnoty glykémií pri danej liečbe nadmerne kolíšu v priebehu dňa ako aj medzi rôznymi dňami) zásadným spôsobom sťažuje glykemickú kontrolu a urýchľuje rozvoj komplikácií. Aj v tomto prípade sú pacienti významne častejšie hospitalizovaní a významne častejšie je u nich indikovaná liečba pomocou inzulínovej pumpy a významne sú zvýšené aj náklady na liečbu súvisiacich komplikácií.
Všetky klinické štúdie, ktoré hodnotili účinnosť inzulínu degludek, boli dizajnované spôsobom „treat-to-target“ (t.j. s cieľom dosiahnutia optimálnej glykemickej kontroly). Preukázali dobrú kompenzáciu diabetu s nižším výskytom hypoglykémií (až o 36 % nižší výskyt závažnej nočnej hypoglykémie), nižšou variabilitou a lepšími hladinami glykémie nalačno.
SPC inzulínu degludek umožňuje použitie samostatne, alebo v kombinácii s prandiálnym inzulínom alebo perorálnymi antidiabetikami. Výhodou pre pacienta tiež je, že inzulín degludek je vďaka farmakokinetickým vlastnostiam možné podávať s určitým posunom v čase s ohľadom na individuálnu situáciu, pričom tento posun nevedie k zhoršeniu glykemickej kontroly. Indikačné obmedzenia by mali zdôvodňovať najmä zásadné medicínske benefity, ktorými je pri prípravku degludek významne nižšie riziko hypoglykémie a nižšia variabilita glykémií. Z konsenzu rokovania odbornej pracovnej skupiny pre antidiabetiká, ministerstva zdravotníctva a zdravotných poisťovní na zasadaní kategorizačnej komisie vzišlo nasledovné znenie indikačných obmedzení.
Bazálne analógy inzulínu – posun liečby do včasných štádií ochorenia. Nové indikačné obmedzenia pre bazálne analógy inzulínu
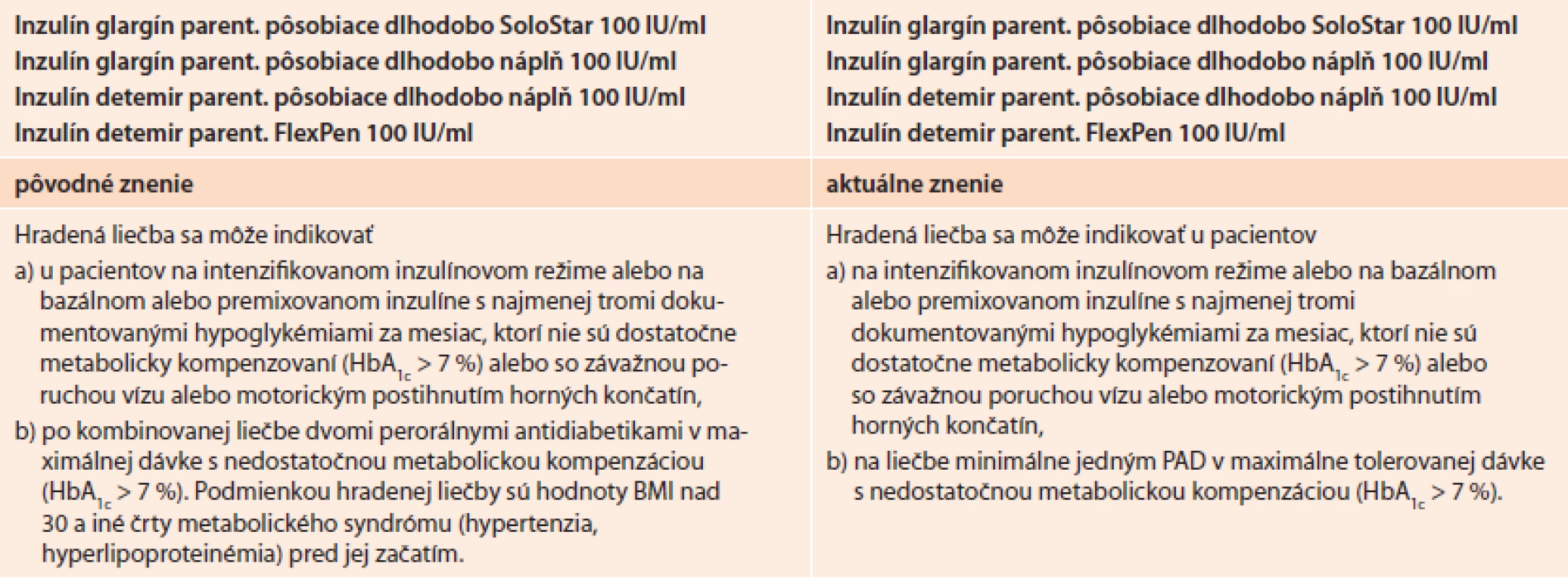
Od 1. 7. 2013 na Slovensku platia nové indikačné obmedzenia pre liečbu pomocou bazálnych analógov inzulínu (tab. 3). Aj toto nové znenie vzišlo s konsenzu rokovania odbornej pracovnej skupiny pre antidiabetiká, ministerstva zdravotníctva a zdravotných poisťovní na podnet, ktorý iniciovala Slovenská diabetologická spoločnosť na základe poznatkov medicíny založenej na dôkazoch (EBM).
Naša argumentácia bola založená na skutočnosti, že diabetes mellitus 2. typu je veľmi heterogénne ochorenie, čo zdôrazňuje aj referenčný algoritmus ADA a EASD tým, že odporúča širokú možnosť kombinácie farmák v kombinácii s metformínom pri nedostatočnom účinku metformínu samotného. Miesto na tejto pozícii majú nielen prípravky sulfonylurey, glitazóny, inhibítory DPP4, agonisty GLP1-receptora ale logicky aj inzulín. Pridanie bazálneho analógu k metformínu, ako prvý krok intenzifikácie, sa využíva pre niekoľko špecifických predností, medzi ktoré patrí najmä najsilnejší efekt na zníženie glykémie a HbA1c a najdlhšie pretrvávanie takéhoto efektu spomedzi všetkých antidiabetických farmák, overená bezpečnosť a spomalenie progresie vývoja diabetes mellitus, čo je dôležité z hľadiska prevencie chronických komplikácií [41]. Keďže pre prognózu pacienta je rozhodujúca intenzívna glykemická kontrola počas prvých 10–15 rokov od diagnózy ochorenia, je dôležité, aby pridanie bazálneho analógu bolo možné už od najvčasnejších štádií. V súčasnej dobe sa za takého považuje možnosť pridania k liečbe po zlyhaní monoterapie metformínom, resp. iným PAD pri intolerancii metformínu. Podľa predtým platných indikačných obmedzení pre bazálne analógy inzulínu takýto postup nebol možný. Podmienkou bola predošlá minimálne dvojkombinácia perorálnych antidiabetík a navyše prítomnosť obezity a iných čŕt metabolického syndrómu, čo znemožňovalo ich využitie práve u pacientov, u ktorých bolo medicínsky aj ekonomicky najefektívnejšie a najracionálnejšie. Pôvodné podmienky indikačných obmedzení teda nielenže postrádali medicínske zdôvodnenie, ale boli aj priamo v rozpore s najnovšími poznatkami.
Bifázické analógy inzulínu – posun liečby do včasných štádií ochorenia. Nové indikačné obmedzenia pre bifázické analógy inzulínu predmetom aktuálnych rokovaní
Významný posun sa dosiahol aj pri úpravách indikačných obmedzení pre bifázické analógy inzulínu. Na podnet SDS sa začalo jednanie s cieľom zjednodušiť použitie týchto prípravkov a posunúť možnosť ich používania už do štádia zlyhania monoterapie PAD. Použitie bifazických analógov inzulínu je podľa odporúčaní referenčných algoritmov (EASD/ADA) podobne ako pri bazálnych analógoch preferovanou voľbou výberu u pacientov s nedostatočnou glykemickou kontrolou pri liečbe jedným alebo viacerými perorálnymi antidiabetikami. V porovnaní s klasickými prípravkami na báze humánneho inzulínu poskytujú predovšetkým nižšie riziko hypoglykémie, prírastku na hmotnosti a nižšiu variabilitu účinku. Podľa zatiaľ ešte stále platných indikačných obmedzení pre bifázické analógy inzulínu je podmienkou použitia predošlá minimálne dvojkombinácia perorálnych antidiabetík a navyše prítomnosť obezity a iných čŕt metabolického syndrómu, čo znemožňuje ich využitie práve u pacientov, u ktorých by bolo medicínsky aj ekonomicky najefektívnejšie a najracionálnejšie. SDS a OPS podobne ako pri bazálnych analógoch predložila návrh na zmenu indikačných obmedzení pre bifázické analógy, ktorý sa stretol aj s pozitívnym postojom poisťovní a bol posunutý do konečného jednania na kategorizačnej komisii.
doc. MUDr. Emil Martinka, PhD.
martinka@nedu.sk
Národný endokrinologický a diabetologický ústav, diabetologické oddelenie
www.nedu.sk
Doručené do redakcie 22. 5. 2013
Zdroje
1. Albers JW, Herman WH, Pop-Bussui H et al. Effect of prior intensive insulin treatment during the Diabetes Control and Complications Trial (DCCT) on peripheral neuropathy in type 1 diabetes during the Epidemiology of Diabetes Interventions and Complications (EDIC) Study. Diabetes Care 2010; 33(5): 1090–1096.
2. Aschner P, Kipnes MS, Lunceford JK et al. Effect of the dipeptidyl peptidase-4 inhibitor sitagliptin as monotherapy on glycemic control in patients with type 2 diabetes. Diabetes Care 2006; 29(12): 2632–2637.
3. Bosi E, Camisasca RP, Collober C et al. Effects of vildagliptin on glucose control over 24 weeks in patients with type 2 diabetes inadequately controlled with metformin. Diabetes Care 2007; 30(4): 890–895.
4. Dejager S, Schweizer A, Foley J. Evidence to support the use of vildagliptin monotherapy in the treatment of type 2 diabetes mellitus. Vasc Health Risk Manag 2012; 8 : 339–348.
5. Del Prato S, Barnett AH, Huisman H et al. Effect of linagliptin monotherapy on glycaemic control and markers of β-cell function in patients with inadequately controlled type 2 diabetes: a randomized controlled trial. Diabetes Obes Metab 2011; 13(3): 258–267.
6. Fadini GP, Boscaro E, Albiero M et al. The oral dipeptidyl peptidase-4 inhibitor sitagliptin increases circulating endothelial progenitor cells in patients with type 2 diabetes: possible role of stromal-derived factor-1alpha. Diabetes Care 2010; 33(7): 1607–1609.
7. Frederich R, Alexander JH, Fiedorek FT et al. A systematic assessment of cardiovascular outcomes in the saxagliptin drug development program for type 2 diabetes. Postgrad Med 2010; 122(3):16–27.
8. Ferrannini E, Fonseca V, Zinman et al. Fifty-two-week efficacy and safety of vildagliptin vs. glimepiride in patients with type 2 diabetes mellitus inadequately controlled on metformin monotherapy. Diabetes Obes Metab 2009; 11(2): 157–166.
9. Gallwitz B et al. Linagliptin has similar efficacy to glimepiride but improved cardiovascular safety over two years in patients with type 2 diabetes inadequately controlled on metformin. ADA 2011; Abstract 39-LB.
10. Gallwitz B, Rosenstock J, Rauch T et al. 2-year efficacy and safety of linagliptin compared with glimepiride in patients with type 2 diabetes inadequately controlled on metformin: a randomized, double-blind, non-inferiority trial. Lancet 2012; 380(9840): 475–483.
11. Garber AJ, Foley JE, Banerji MA et al. Effects of vildagliptin on glucose control in patients with type 2 diabetes inadequately controlled with a sulphonylurea. Diabetes Obes Metab 2008; 10(11): 1047–1056.
12. Göke B, Hershon K, Kerr D et al. Efficacy and safety of vildagliptin monotherapy during 2-year treatment of drug-naïve patients with type 2 diabetes: comparison with metformin. Horm Metab Res 2008; 40(12): 892–895.
13. Hermansen K, Kipnes M, Luo E et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor, sitagliptin, in patients with type 2 diabetes mellitus inadequately controlled on glimepiride alone or on glimepiride and metformin. Diabetes Obes Metab 2007; 9(5): 733–745.
14. Holman R, Paul SK, Bethel MA et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008; 359(15): 1577–1589.
15. Charbonnel B, Karasik A, Liu J et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor sitagliptin added to ongoing metformin therapy in patients with type 2 diabetes inadequately controlled with metformin alone. Diabetes Care 2006; 29(12): 2638–2643.
16. Inzucchi SE, Bergenstal RM, Buse JB et al (American Diabetes Association, European Association for the Study of Diabetes). Management of hyperglycemia in type 2 diabetes: a patient-centered approach: position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2012; 35(6): 1364–1379.
17. Johansen OE, Neubacher D, von Eynatten M et al. Cardiovascular safety with linagliptin in patients with type 2 diabetes mellitus: a pre-specified, prospective, and adjudicated meta-analysis of a phase 3 programme. Cardiovasc Diabetol 2012; 11 : 3. Dostupné z DOI: <http://doi: 10.1186/1475–2840–11–3>.
18. Johnson JA, Majumdar SR, Simpson SH. Decreased mortality associated with the use of metformin compared with sulfonylurea monotherapy in type 2 diabetes. Diabetes Care 2002; 25(12): 2244–2248.
19. Jose E, Inzucchi E. Cardiovascular effects of the DPP-4 inhibitors. Diabetes and Cardiovascular Disease Research 2012. Dostupné z DOI: <http://doi: 10.1177/1479164111436236>.
20. Kothny W, Foley J, Kozlovski P et al. Improved glycaemic control with vildagliptin added to insulin, with or without metformin, in patients with type 2 diabetes mellitus. Diabetes Obes Metab 2013; 15(3): 252–257.
21. Laviola L, Leonardini A, Melchiorre M et al. Glucagon-like peptide-1 counteracts oxidative stress-dependent apoptosis of human cardiac progenitor cells by inhibiting the activation of the c-Jun N-terminal protein kinase signaling pathway. Endocrinology 2012; 153(12): 5770–5781.
22. Lønborg J, Vejlstrup N, Kelbæk H et al. Exenatide reduces reperfusion injury in patients with ST-segment elevation myocardial infarction. Eur Heart J 2012; 33(12): 1491–1499.
23. Wing RR et al (Look AHEAD Research Group). Long-term effects of a lifestyle intervention on weight and cardiovascular risk factors in individuals with type 2 diabetes mellitus: four-year results of the Look AHEAD trial. Arch Intern Med 2010; 170(17): 1566–1575.
24. Lukashevich V, Wang M, DelPrato S et al. Vildagliptin efficacy and safety in patients with type 2 diabetes inadfequately controlled on dual metformin plus sulfonylurea therapy. Poster 856. Presented at the 48th EASD 2012, 1–5th Oct, Berlin, Germany.
25. Makdissi A, Ghanim H, Vora M et al. Sitagliptin exerts an antinflammatory action. J Clin Endocrinol Metab 2012; 97(9): 3333–3341.
26. Nathan DM, Cleary PA, Backlund JY et al. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes. N Engl J Med 2005; 353(25): 2643–2653.
27. Nauck MA, Meininger G, Sheng D et al (Sitagliptin Study 024 Group). Efficacy and safety of the dipeptidyl peptidase-4 inhibitor, sitagliptin, compared with the sulfonylurea, glipizide, in patients with type 2 diabetes inadequately controlled on metformin alone: a randomized, double-blind, non-inferiority trial. Diabetes Obes Metab 2007; 9(2):194–205.
28. Nikolaidis LA, Mankad S, Sokos GG. Effects of glucagon-like peptide-1 in patients with acute myocardial infarction and left ventricular dysfunction after successful reperfusion. Circulation 2004; 109(8): 962–965.
29. Owens DR, Swallow R, Dugi KA et al. Efficacy and safety of linagliptin in persons with type 2 diabetes inadequately controlled by a combination of metformin and sulphonylurea: a 24-week randomized study. Diabet Med 2011; 28(11): 1352–1361.
30. Pratley RE, Rosenstock J, Pi-Sunyer FX et al. Management of type 2 diabetes in treatment-naive elderly patients: benefits and risks of vildagliptin monotherapy. Diabetes Care 2007; 30(12): 3017–3022.
31. Read PA, Khan FZ, Heck PM et al. DPP-4 inhibition by sitagliptin improves the myocardial response to dobutamine stress and mitigates stunning in a pilot study of patients with coronary artery disease. Circ Cardiovasc Imaging 2010; 3(2): 195–201.
32. Scheen A, Paquot N. Gliptin versus a sulphonylurea as add-on to metformin. The Lancet 2012; 380(9840):450–452.
33. Schweizer A, Dejager S, Bosi E. Comparison of vildagliptin and metformin monotherapy in elderly patients with type 2 diabetes: a 24-week, double-blind, randomized trial. Diabetes Obes Metab 2009; 11(8): 804–812.
34. Schweizer A, Couturier A, Foley JE et al. Comparison between vildagliptin and metformin to sustain reductions in HbA1c over 1 year in drug-naïve patients with type 2 diabetes. Diabet Med 2007; 24(9): 955–961.
35. Schweizer A, Couturier A, Foley JE et al. Assessing the cardio-cerebrovascular safety of vildagliptin: meta-analysis of adjudicated events from a large phase III type 2 diabetes population. Diabetes Obes Metab 2010; 12(6): 485–494.
36. Takahashi M. Role of the SDF-1/CXCR4 system in myocardial infarction . Circ J 2010; 74(3): 418–423.
37. Taskinen MR, Rosenstock J, Tamminen I et al. Safety and efficacy of linagliptin as add-on therapy to metformin in patients with type 2 diabetes: a randomized, double-blind, placebo-controlled study. Diabetes Obes Metab 2011; 13(1): 65–74.
38. The Action to Control Cardiovascular Risk in Diabetes Study Group. Effect of intensive glucose lowering in patients with type 2 diabetes. N Engl J Med 2008, 358(24): 2545–2559.
39. The ADVANCE Collaborative Goup. Intensive blood glucose control and Vascular Outcomes in type 2 diabetes. N Engl J Med 2008, 358(24): 2560–2569.
40. The NICE-SUGAR Study Investigators. Intensive versus Conventional Glucose Control in Critically Ill Patients. N Engl J Med 2009; 360(13): 1283–1297.
41. The Origin Trial Investigators. Basal Insulin and Cardiovascular and Other Outcomes in Dysglycemia. N Engl J Med 2012; 367(4): 319–328.
42. Trajenta® (linagliptin) tablets. EMA Summary of Product Characteristics. 2011. Dostupné z WWW: <http://www.ema.europa.eu>.
43. Vilsbøll T, Rosenstock J, Yki-Järvinen H et al. Efficacy and safety of sitagliptin when added to insulin therapy in patients with type 2 diabetes. Diabetes Obes Metab 2010; 12(2): 167–177.
44. Zaruba MM, Theiss HD et al. Synergy between CD26/DPP-IV inhibition and G-CSF improves cardiac function during acute myocardial infarction. Cell Stem Cell 2009; 4(4): 313–323.
Štítky
Diabetologie Endokrinologie Interní lékařstvíČlánek vyšel v časopise
Forum Diabetologicum

2014 Číslo 2
Nejčtenější v tomto čísle
- Co obnáší přijetí nových mezinárodních doporučení pro screening a diagnózu gestačního diabetes mellitus?
- Starostlivosť o dieťa diabetickej matky
- Vedenie tehotnej diabetičky diabetológom
- Pôrodnícky manažment diabetičiek 1. a 2. typu
