6 Odporúčané postupy pri liečbe diabetes mellitus 2. typu
Vyšlo v časopise:
Forum Diab 2018; 7(Suppl 1): 36-52
6.1 Úvod
Diabetes mellitus 2. typu (DM2T) je veľmi časté a závažné ochorenie, ktoré vedie k poškodeniu prakticky všetkých tkanív a orgánových systémov ľudského organizmu. Diagnóza DM2T býva mnohokrát oneskorená, preto niektoré dôsledky možno identifikovať už v čase diagnózy. Ide o veľmi komplexné ochorenie, ktoré okrem metabolizmu glukózy zasahuje aj ďalšie pochody intermediárneho metabolizmu, ako je metabolizmus krvných tukov, elektrolytov, aminokyselín. Navodzuje chronický subklinický zápal, nepriaznivo ovplyvňuje funkcie endotelu, vplýva na cievnu reaktivitu, reguláciu krvného tlaku a ďalšie fyziologické deje. Situáciu komplikuje skutočnosť, že nejde o jedno ochorenie, ale o heterogénnu skupinu s účasťou viacerých patofyziologických mechanizmov v rôznom pomere zastúpenia. Navyše, s trvaním ochorenia a prítomnosťou jednotlivých komplikácií a komorbidít sa významne mení „základný terén“ pacienta. To vyžaduje zmenu filozofie, požiadaviek, cieľov a preferencií liečby. Terapeutický prístup ku každému pacientovi s DM2T tak vyžaduje individualizáciu i obvykle kombinovanú a komplexnú liečbu s využitím účinku farmák na viacerých úrovniach. Aktuálnou „filozofiou“ prístupu k výberu účinných látok je odporúčanie založené na dôkaze ich morbiditno-mortalitného alebo patofyziologického benefitu pre konkrétneho pacienta.
Účinok jednotlivých skupín antidiabetík na zníženie glykémie je porovnateľný. Rozdiely sú však v podiele pacientov, ktorí dosiahli požadované kritériá, vo vplyve na telesnú hmotnosť, vo výskyte hypoglykémií, v závažnosti špecifických nežiaducich účinkov, potenciálnych rizikách a v kontraindikáciách. Keďže hlavnou príčinou morbidity a mortality pacientov s DM2T sú kardiovaskulárne ochorenia a renálne komplikácie, dôležitou charakteristikou jednotlivých farmák je aj ich konkrétny efekt na riziko kardiovaskulárnej (KV), renálnej či onkologickej morbidity a mortality.
Kým efekt vlastnej úpravy glykémie na redukciu mikrovaskulárnych komplikácií je nepochybný, hodnotenie významu normalizácie glykémie na KV-komplikácie je skôr rozpačitý a už dávnejšie sa poukazovalo aj na potenciálne riziká pri viacerých účinných látkach, najmä na zvýšené riziko srdcového zlyhávania a KV-mortality. Aj z tohto dôvodu je jednou z hlavných požiadaviek liekových agentúr FDA (U.S. Food and drug administration) a EMA (European Medicines Agency), aby liek na liečbu diabetu KV-riziko nezvyšoval. V posledných 3 rokoch boli publikované výsledky niekoľkých štúdií zameraných na testovanie KV-bezpečnosti novších farmák na liečbu DM2T, ktoré vzbudili mimoriadnu pozornosť a stali sa jednými z najvýznamnejších v diabetológii. Ukázali, že zatiaľ čo niektoré molekuly (obzvlášť empagliflozín, liraglutid, semaglutid) dokážu významne a priaznivo ovplyvniť KV-morbiditu a mortalitu aj progresiu nefropatie, iné účinné látky majú neutrálny efekt alebo môžu dokonca predstavovať zvýšené riziko. Rozdiely pritom nie sú iba medzi skupinami, ale aj medzi jednotlivými účinnými látkami v rámci rovnakých skupín. A keďže zatiaľ sa ani v jednej zo skupín neukázal komplexný „class“ efekt týkajúci sa morbiditno-mortalitného prínosu alebo parametrov bezpečnosti, je potrebné hodnotiť každú účinnú látku zvlášť. To zdôvodňuje preferenčný výber niektorých z nich, čo sa uplatňuje aj v aktuálnom terapeutickom odporúčaní SDS.
Pre adekvátnu interpretáciu výsledkov všetkých doterajších kľúčových štúdií v diabetológii, najmä UKPDS, ACCORD, ADVANCE, ORIGIN, a novších štúdií ako EMPA-REG Outcome, LEADER, SUSTAIN-6, CVD-REAL, CANVAS Program, EXSCEL je potrebné vnímať ich vždy v súvislostiach niekoľkých rovín. Do úvahy treba brať jednak skutočnosť, akí pacienti boli predmetom skúšania (t. j. či išlo o pacientov s novozisteným diabetom bez komplikácií, alebo išlo už o pacientov s pokročilým ochorením a rozvinutými KV-komplikáciami, resp. s prekonanými KV-príhodami). Potrebné je tiež zohľadniť formuláciu problému, ktorý bol sledovaný (t. j. či cieľom bola prevencia KV-príhod, alebo ich mortalitné dôsledky), a tiež ako bol definovaný primárny ukazovateľ, t. j. či bol efekt liečby na jednotlivé zložky kompozitného cieľa homogénny, alebo, naopak, heterogénny. Je tiež dôležité poznať obdobie, v ktorom skúšanie prebiehalo (vzhľadom na vtedajšie možnosti liečby), a aké bolo pozadie využitia iných liekov so známym prínosom na morbiditu a mortalitu, ako sú statíny či ACE-inhibítory, alebo, naopak, rizikom. Napokon, aj keď sa DM2T často uniformne považuje za akýsi ekvivalent kardiovaskulárného ochorenia (KVO), je známe, že KV-riziko je rozdielne a narastá s trvaním ochorenia a prítomnosťou súbežných metabolických defektov a komplikácií. Z tohto náčrtu vyplýva, že efekt jednotlivých účinných látok nemožno generalizovať ani na celú skupinu pacientov s DM2T, ani na všetky fázy ochorenia, ale ich výber by mal byť individualizovaný s ohľadom na prínosy a riziká u konkrétneho pacienta. Uvedené princípy sa objavili už v odporúčaniach SDS z roku 2016 a boli vôbec jednými z prvých, ktoré inkorporovali výsledky nedávnych štúdií zameraných na sledovanie KV-morbidity a mortality (tzv. CVOT štúdie) do preferenčného výberu liečby u konkrétneho pacienta s cieľom znížiť konkrétne morbiditno-mortalitné riziko. V súčasnosti je takýto prístup aj súčasťou odporúčaní ADA/EASD, CEEDEG, CDA a ďalších.
6.2 Aktuálne spektrum farmák využívaných v antidiabetickej liečbe a ich miesto v terapeutických schémach (schéma 6.1)

6.2.1 Biguanidy
Metformín (tab. 6.1) sa považuje za antidiabetikum s dôkazom makrovaskulárneho prínosu, primárnej prevencie infarktu myokardu a redukcie úmrtia z akejkoľvek príčiny, ak sa podáva vo včasnom štádiu DM2T. Z tohto dôvodu metformín zostáva preferovanou liečbou prvej voľby vo všetkých referenčných terapeutických odporúčaniach. Nie je však známe, či metformín takýto efekt dosahuje aj v pokročilejších štádiách u komplikovaných pacientov po prekonaní niektorej z KV-príhod. Navyše, UKPDS ani „follow-up“ tejto štúdie nepreukázali redukciu mikrovaskulárnych komplikácií, ako k tomu došlo v prípade sulfonylurey a inzulínu. Napriek tomu metformín by mal byť (aj s ohľadom na ďalšie potenciálne prínosy) trvalou súčasťou terapeutickej schémy aj v neskorších štádiách ochorenia. KV-benefit metformínu nesúvisí „iba“ s vplyvom na glykémiu, ale uplatňuje sa zrejme celý rad ďalších účinkov. Metformín potláča hepatálnu produkciu glukózy a zlepšuje citlivosť periférnych tkanív na inzulín. Stimuláciou sekrécie a expresie génu pre proglukagón zvyšuje hladinu GLP-1. Stimuluje sekréciu adiponektínu, visfatínu a RBP4. Prejavuje priaznivý efekt na krvné tuky, endotel, redukuje hladiny markerov chronického subklinického zápalu, znižuje hladiny inhibítora plazminogénového aktivátora 1 (PAI-1), doštičkového faktora 4 (PF-4), beta-tromboglobulínu (β-TGb) a v niektorých prípadoch sa mu pripisuje aj antikarcinogénny efekt. Metformín zatiaľ zostáva liečbou prvej línie a trvalou súčasťou („kostrou“) liečby aj v aktuálnom odporúčaní SDS.

Nedávno bola v SPC lieku Glucophage obsahujúcom metformín rozšírená možnosť jeho používania aj u pacientov s chronickým renálnym ochorením (CKD) až do hodnoty odhadovanej glomerulovej filtrácie (eGFR) 30 ml/min/1,73 m2 v redukovanej maximálnej dávke do 1 000 mg (schéma 6.3.2). Pri iných prípravkoch metformínu však zatiaľ takáto úprava nebola publikovaná v SPC a uvádza sa hodnota eGFR do 45 ml/min/1,73 m2. Podľa nedávneho prieskumu NEFRITI metformín na Slovensku využíva asi 80 % pacientov s DM2T.
6.2.2 Prípravky na báze sulfonylurey
Účinné látky na báze sulfonylurey (SU) sú jednou z najstarších a najobsiahlejších skupín perorálnych antidiabetík (glibenklamid, glimepirid, gliklazid, glipizid, gliquidon – tab. 6.2). Spoločným menovateľom je stimulácia sekrécie inzulínu, relatívne silný efekt na pokles glykémií a nízka cena. Prípravky SU majú potvrdený prínos v redukcii mikrovaskulárnych komplikácií. Kardiovaskulárna bezpečnosť je však sporná a väčšina analýz zdôrazňuje potenciálne zvýšené riziko KV-mortality, a to nielen u pacientov s jestvujúcim KVO, resp. KV-príhodou, ale aj u pacientov bez predošlej KV-príhody. FDA v tejto súvislosti uvádza špeciálne varovanie. Nevýhodou je tiež zvýšené riziko hypoglykémie a prírastok na hmotnosti. Tieto nevýhody v súčasnosti vytláčajú prípravky SU zo všetkých pozícií terapeutických schém. V roku 2014 však boli podľa prieskumu NEFRITI využívané u 42 % pacientov s DM2T. Výnimkou spomedzi SU prípravkov v názoroch na ich terapeutickú hodnotu a bezpečnosť je gliklazid MR, ktorý má EBM potvrdenú KV-bezpečnosť, má nízke riziko hypoglykémie (porovnateľné s gliptínmi), hmotnostne je prakticky neutrálny a prejavuje šetriaci efekt na B-bunky. Okrem toho, v intenzívnom ramene štúdie ADVANCE, ktorého stabilnou súčasťou bola liečba gliklazidom MR, bola dosiahnutá aj redukcia mikroalbuminúrie a spomalenie progresie CKD do štádia zlyhania obličiek. Tieto benefity gliklazidu MR boli potvrdené vo viacerých štúdiách zásadného významu. Gliklazid MR sa preto stal preferovaným prípravkom SU aj v aktuálnom odporúčaní SDS, podobne ako v odporúčaniach iných krajín. Miesto prípravkov SU (s preferenciou gliklazidu MR) v odporúčaniach SDS je predovšetkým v kombinácii s metformínom a inými antidiabetikami vrátane inzulínu a tiež ako jedna z alternatív iniciácie liečby DM2T pri intolerancii alebo kontraindikácii metformínu alebo ako iniciálna liečba dvojkombináciou s metformínom u pacientov s HbA1c > 9 % v čase diagnózy DM2T (schéma 6.2, viď 3. strana obálky).

6.2.3 Inhibítory dipeptidylpeptidázy 4 (iDPP4, gliptíny)
Relatívne nová skupina farmák, ktoré účinkujú prostredníctvom inhibície štiepenia inkretínových hormónov produkovaných črevom, predovšetkým peptidu 1 podobného glukagónu (glucagon-like peptide 1 – GLP-1) a glukózovo dependentného inzulínotropného peptidu (glucose-dependent insulinotropic peptide – GIP), čím zvyšujú ich hladiny (tab. 6.3). V súčasnosti sem patrí množstvo účinných látok ako sitagliptín, vildagliptín, alogliptín, linagliptín, saxagliptín, gemigliptín, anagliptín, teneligliptín, evogliptín a mnoho ďalších. Na Slovensku je kategorizovaných prvých päť z nich. Vďaka komplexnému efektu na kontrolu glykémie (stimulácia sekrécie inzulínu, supresia sekrécie glukagónu, spomalenie vyprázdňovania žalúdka) možno pri týchto liekoch očakávať síce mierny, ale spoľahlivý prídavný efekt na úpravu glykémií a HbA1c pri všetkých terapeutických kombináciách vrátane kombinácie s inzulínom. Hlavnou výhodou gliptínov (obzvlášť v porovnaní s bežnými prípravkami SU) je nízky výskyt hypoglykémie a hmotnostná neutralita. Za ďalšie prínosy možno považovať priaznivý efekt na redukciu krvného tlaku, úpravu hladín lipidov v krvi aj úpravu parametrov chronického subklinického zápalu a podporu „recruitmentu“ kmeňových angiogénnych buniek v ischemickom myokarde. V doterajších klinických štúdiách zameraných na KV-morbiditu a mortalitu sa však zatiaľ prínos neprejavil. Naopak, pri niektorých prípravkoch ako saxagliptín a čiastočne alogliptín vznikla obava zo zvýšeného rizika srdcového zlyhávania, ak sa podávali pacientom s vysokým KV-rizikom. Nejde však o „class“ efekt, keďže pri iných prípravkoch (sitagliptín v štúdii TECOS) sa takéto riziko nepotvrdilo a pri ďalších (linagliptín) štúdie ešte prebiehajú. Sitagliptín je zatiaľ jedinou účinnou látkou spomedzi iDPP4, ktorá má potvrdenú kardiovaskulárnu bezpečnosť randomizovanou CVOT štúdiou. V niektorých prácach zlepšoval funkčnú odpoveď myokardu počas dobutamínovej ergometrie. Výhodou linagliptínu je zas možnosť jeho použitia aj u pacientov v terminálnom štádiu ochorenia obličiek (schéma 6.3.2). Diskutuje sa aj o možnom benefite iDPP4 v súvislosti s rizikom cievnej mozgovej príhody.

Na druhej strane, zásadnou otázkou, ktorá vzišla z klinických štúdií a bola rôzne interpretovaná aj pri viacerých metaanalýzach, je pretrvávajúca obava zo zvýšeného rizika akútnej pankreatitídy, ktoré bolo potvrdené, a rizika karcinómu pankreasu, ktoré nebolo potvrdené. Odporúčaním SDS je vnímať a zohľadňovať toto riziko aj pri preskripcii a následnom sledovaní pacienta, nepodávať iDPP4 (gliptíny) pacientom s prekonanou pankreatitídou a uvážiť vhodnosť podávania gliptínov pacientom s prítomnými rizikovými faktormi pre jej vznik. V aktuálnych odporúčaniach SDS sú gliptíny, obzvlášť sitagliptín, resp. linagliptín, z dôvodu kardiovaskulárnej, resp. renálnej, bezpečnosti a tiež s ohľadom na SPC a indikačné obmedzenie (IO) alternatívou iniciálnej monoterapie pri intolerancii alebo kontraindikácii metformínu, jednou z možností výberu do dvojkombinácie s metformínom, do trojkombinácie s metformínom a so sulfonylureou, ako aj do kombinácie s inzulínom, spolu so súčasnou liečbou metformínom alebo bez nej, obzvlášť u pacientov s redukciou renálnych funkcií, rizikom dehydratácie, hypotenzie, urogenitálnych infekcií a potenciálne aj u pacientov po prekonaní cievnej mozgovej príhody. Indikačné obmedzenie je pomerne široké a umožňuje naplniť väčšinu medicínskych požiadaviek. Zatiaľ však neumožňuje používať gliptíny v kombinácii s gliflozínmi, agonistami GLP-1 receptorov či glitazónmi. V prípade glitazónov je výnimkou možnosť použitia kombinovaného prípravku alogliptínu a pioglitazónu, za predpokladu, že liečbe predchádzala liečba pioglitazónom samostatne alebo v kombinácii s metformínom. Podľa prieskumu NEFRITI sa gliptíny v roku 2014 využívali asi u 20 % pacientov s DM2T.
6.2.4 Agonisty GLP-1 receptorov (tab. 6.4)

Podstatou svojho účinku sú najviac príbuzné gliptínom. Účinok však nezávisí od hladiny a sekrécie vlastných inkretínov, ale receptory pre GLP-1 priamo stimulujú. Efekt na pokles glykémie je výraznejší než pri gliptínoch, riziko hypoglykémie je však nízke. Vedú tiež k poklesu telesnej hmotnosti a výraznejší je aj efekt na pokles krvného tlaku. Zlepšujú profil krvných lipidov, hladiny markerov chronického subklinického zápalu a iných biomarkerov KV-rizika.
Kým prvá RCT CVOT štúdia ELIXA s agonistom GLP-1-receptorov (aGLP1R) lixisenatidom preukázala neutrálny efekt na riziko KV-morbidity a mortality, výsledky štúdie LEADER s liraglutidom, preukázali signifikantný benefit liečby nielen v primárnom kompozitnom cieli zloženom z KV-úmrtia, nefatálneho infarktu myokardu a nefatálnej mozgovej príhody, ale aj v jeho jednotlivých zložkách. Liečba liraglutidom viedla k signifikantnej redukcii úmrtia z KV-príčin o 22 %, redukcii výskytu nefatálneho infarktu myokardu o 12 % na hranici štatistickej významnosti a redukcii nefatálnej mozgovej príhody o 11 %, ktorá však nedosiahla štatistickú významnosť. Štúdia LEADER trvala 5 rokov a bola realizovaná na populácii s viac ako 9 000 pacientmi s DM2T s vysokým KV-rizikom. Signifikantný benefit v rovnakom primárnom kompozitnom cieli preukázal aj ďalší zástupca aGLP1R semaglutid, v štúdii SUSTAIN-6. V rámci jednotlivých komponentov semaglutid síce neviedol k redukcii KV-úmrtia ani k redukcii výskytu nefatálneho infarktu myokardu, viedol však k signifikantnej redukcii nefatálnej mozgovej príhody, a to až o 39 %, a k redukcii potreby revaskularizácií na periférnych cievach o 35 %. Výsledky len nedávno zverejnenej RCT CVOT štúdie EXSCEL s exenatidom QW viedli k hraničnej redukcii kompozitného cieľa, liečba sa však spájala so signifikantným poklesom úmrtia z akejkoľvek príčiny o 14 %. Ukazuje sa tak, že medzi jednotlivými zástupcami aGLP1R v otázkach efektu na KV-morbiditu a mortalitu sú viaceré rozdiely, preto je potrebné hodnotiť ich individuálne. Porovnanie výsledkov jednotlivých CVOT štúdií s aGLP1R zobrazuje tab. 6.7, v ktorej sú uvedené aj výsledky štúdií s inhibítormi SGLT2 kotransportu (iSGLT2). Je zrejmé, že zatiaľ čo iSGLT2 empagliflozín redukoval hlavne mortalitné dôsledky predtým prekonaných KV-príhod a ochorení, a to pravdepodobne prostredníctvom priaznivého efektu na zlyhávajúci myokard, pri aGLP1R sa vplyv na srdcové zlyhávanie síce neprejavil, ale ako hlavný benefit sa javil skôr výskyt samotných KV-príhod. Predpokladá sa preto, že pri aGLP1R by mechanizmus priaznivého účinku mohol ovplyvňovať samotný proces aterogenézy. Rozdiely v účinkoch tak prinášajú v možnostiach ovplyvnenia KV-rizika a mortality ďalší rozmer a poukazujú na miesto a využitie oboch skupín v terapeutických schémach DM2T.
Podobne ako pri iSGLT2 aj pri aGLP1R sa okrem KV-benefitov prejavil nefroprotektívny efekt, keď liečba liraglutidom, resp. semaglutidom viedla k redukcii progresie nefropatie o 22 %, resp. 36 %. Pri niektorých zástupcoch aGLP-1R postačuje podanie 1-krát za týždeň (dulaglutid, exenatid QW a semaglutid, ktorého kategorizácia sa očakáva v blízkej budúcnosti). Výsledky RCT CVOT štúdie REWIND s dulaglutidom sa očakávajú po ukončení štúdie v júli 2017 a ich následnom spracovaní. Aktuálnou výhodou dulaglutidu je možnosť podávania aj pri znížení eGFR na > 15 ml/min/1,73 m2.
V aktuálnom terapeutickom odporúčaní SDS, zohľadňujúcom efekt aGLP1R na pokles glykémie, výsledky CVOT štúdií, multifaktoriálny benefit na KV-biomarkery, SPC, ale aj aktuálne znenie IO, možno aGLP1R považovať za optimálnu voľbu do dvojkombinácie s metformínom a do trojkombinácie s metformínom a so sulfonylureou. Nedávno sa možnosť využitia agonistov GLP-1-receptora rozšírila aj na kombináciu s bazálnym inzulínom. Pri hradenej liečbe však táto indikácia zatiaľ platí iba pre prípravok s fixnou kombináciou inzulínu degludek a liraglutid (iDegLira). Opačný postup, t. j. pridanie inzulínu k predošlej liečbe, aGLP1R indikačné obmedzenie zatiaľ neumožňuje.
Vychádzajúc z EBM, efektívnou sa ukazuje aj liečba inzulínom glargín v kombinácii s lixisenatidom, pri ktorej podobne ako pri iDegLira intenzifikácia liečby bazálnym inzulínom pridaním lixisenatidu viedla k porovnateľnému poklesu HbA1c, no s nižším výskytom hypoglykémií a prírastku na hmotnosti než pri intenzifikácii pridaním 1–3 prandiálnych bolusov (štúdia GetGoal Duo2). Na Slovensku zatiaľ táto kombinácia nie je hradenou liečbou. IO pre hradenú liečbu neumožňuje ani vzájomnú kombináciu aGLP1R-receptorov s inhibítormi SGLT2-kotransportu, inihibítormi DPP4 či s glitazónmi. Pri indikácii liečby je podobne ako pri iných liekoch potrebné rešpektovať kontraindikácie a upozornenia uvedené v SPC. Agonisty GLP1R sa nemajú podávať pacientom s gastroparézou a so zápalovými ochoreniami čriev. Opatrnosť je potrebná u pacientov s ochoreniami štítnej žľazy (bezpečnostné upozornenie FDA – tzv. „black box“ ohľadom rizika tyreoidálnych tumorov C-buniek), anamnézou prekonanej pankreatitídy či s rizikom akútnej pankreatitídy. Pacienti majú byť informovaní o typických príznakoch akútnej pankreatitídy. V prípade podozrenia na pankreatitídu sa má liečba vysadiť, a ak sa pankreatitída potvrdí, nemá sa znovu používať. V doteraz ukončených CVOT štúdiách s aGLP1R sa zvýšené riziko akútnej pankreatitídy ani karcinómu pankreasu nepotvrdilo. V štúdiách LEADER a SUSTAIN-6 bol zaznamenaný vyšší výskyt cholelitiázy a akútnej cholecystitídy v skupine liečených liraglutidom, resp. semaglutidom.
Napriek uvedeným presvedčivým benefitom a nízkemu riziku nežiaducich účinkov je využívanie aGLP1R na Slovensku stále nedostatočné a veľmi nízke je aj v porovnaní s okolitými krajinami. V roku 2014 sa využívali iba u 0,5 % pacientov, čo bolo 5–10-krát menej než v iných európskych krajinách.
6.2.5 Inhibítory SGLT2-kotransportu – gliflozíny (tab. 6.5)
Nová skupina perorálnych antidiabetík s viacerými špecifikami a so zásadným prínosom pre medicínsku prax, ako aj vedecký vývoj názorov. Pokles glykémie sa dosahuje blokovaním spätnej reabsorpcie glukózy z primárneho moču v proximálnom tubule obličiek inhibíciou SGLT2-kotransportu. Dôležitým faktom je, že efekt gliflozínov je nezávislý od sekrécie inzulínu aj od citlivosti tkanív na inzulín. Z uvedeného dôvodu gliflozíny poskytujú významný a spoľahlivý aditívny benefit na kontrolu glykémie nielen pri monoterapii, ale aj pri všetkých kombináciách vrátane kombinácie s inzulínom. Cennou vlastnosťou je aj skutočnosť, že efekt na glykémiu sa dosahuje pri minimálnom riziku hypoglykémie a navyše dochádza k redukcii zvýšenej telesnej hmotnosti. Gliflozíny vedú tiež k poklesu krvného tlaku bez vzostupu frekvencie srdca, k poklesu triglyceridov, k vzostupu HDL, k miernemu nárastu LDL, poklesu kyseliny močovej a poklesu tuhosti ciev. Ako ukázali RCT CVOT štúdie, liečba gliflozínmi prináša viaceré morbiditno-mortalitné benefity zásadného významu. Výsledky prvej publikovanej CVOT štúdie EMPA-REG OUTCOME na populácii viac ako 7 000 pacientov s DM2T s vysokým KV-rizikom a prekonaným KV-ochorením/príhodou preukázali signifikantnú redukciu relatívneho rizika primárneho kompozitného cieľa zloženého z KV-úmrtia, nefatálneho infarktu myokardu a nefatálnej cievnej mozgovej príhody o 14 %. V rámci jednotlivých zložiek kompozitného cieľa dominovala významná redukcia KV-mortality, a to až o 38 %, ktorá sa ukázala aj ako rozhodujúca zložka benefitu v rámci primárneho kompozitného cieľa, zatiaľ čo efekt na výskyt infarktu myokardu a cievnej mozgovej príhody zostal neutrálny. Túto diskrepanciu vysvetlila sekundárna analýza výsledkov, ktorá poukázala na výraznú redukciu potreby hospitalizácií pre srdcové zlyhávanie o 35 % a hospitalizácií alebo úmrtia pre srdcové zlyhávanie až o 39 %. Liečba empagliflozínom tiež viedla k redukcii celkovej mortality o 32 %. Efekt empagliflozínu na mortalitu znamenal, že pri liečbe asi 1 000 pacientov sa zachráni 25 životov alebo že sa predíde jednému z troch KV-úmrtí. Priaznivý efekt na srdcové zlyhávanie sa prejavoval už v prvých týždňoch liečby. Zásadný význam týchto zistení podčiarkuje skutočnosť, že všetky uvedené prínosy boli dosiahnuté v teréne už predošlej vyťaženej liečby statínmi a ACE-inhibítormi, ktoré boli donedávna považované za jediné skupiny s dokázaným KV-benefitom. Navyše, efekt empagliflozínu vo vyjadrení na počet pacientov, ktorých treba liečiť, aby sa predišlo jednému úmrtiu, tzv. „NNT (number needed to treat)“, bol nižší než v prípade simvastatínu či ramiprilu. Empagliflozín prejavoval aj nefroprotektívny efekt. Po pridaní k štandardnej liečbe pacientov s DM2T s vysokým KV-rizikom empagliflozín spomaľoval progresiu obličkovej choroby tým, že signifikantne redukoval vznik novej nefropatie alebo zhoršenie jestvujúcej nefropatie o 39 %, progresiu do makroalbuminúrie o 38 %, progresiu do zdvojnásobenia hodnoty kreatinínu v sére o 44 % a začiatok potreby dialýzy alebo transplantácie obličiek o 55 %. Renálny benefit bol zhodný u pacientov s predošlou nefropatiou aj bez nej a dostavil sa ako efekt „navyše“ k liečbe inhibítorom renín-angiotenzín-aldosterónového systému (RAAS). Kardiovaskulárny efekt sa vysvetľuje komplexne, a to diuretickým efektom vedúcim k redukcii extracelulárneho objemu tekutín a „pre-loadu“ srdca, vzostupom hematokritu s relatívne vyššou dodávkou kyslíka ku tkanivám, ovplyvnením energetického metabolizmu ischemického myokardu so zlepšením systolickej a diastolickej funkcie srdca a s efektom na periférne cievy, vedúcim k redukcii „after-loadu“. Renálny efekt sa vysvetľuje prostredníctvom tubuloglomerulového „feedbacku“, ktorý v reakcii na vyššiu koncentráciu Na+, navodenú liečbou, v oblasti macula densa v dôsledku redukcie kotransportu Na+ a glukózy v proximálnom tubule vedie k vazokonstrikcii aferentnej arterioly glomerulu s následnou redukciou intraglomerulového tlaku a normalizáciou glomerulovej filtrácie.
Výsledky inej, nedávno zverejnenej RCT CVOT štúdie s kanagliflozínom CANVAS Program boli podobné aj odlišné. Liečba kanagliflozínom viedla k významnej redukcii relatívneho rizika v rovnakom primárnom kompozitnom cieli o 14 %, významnej redukcii potreby hospitalizácií pre srdcové zlyhávanie o 33 % a tiež k významnej redukcii progresie nefropatie o 27 % (progresie albuminúrie) až 40 % (redukcia GF, dialýza, transplantácia alebo úmrtie pre renálnu príčinu). Liečba kanagliflozínom však na rozdiel od empagliflozínu neviedla k redukcii KV ani celkovej mortality. Treba tiež spomenúť, že liečba kanagliflozínom viedla aj k zvýšenému výskytu fraktúr a amputácií (bezpečnostné upozornenie FDA „black box“) na dolných končatinách, čo pri empagliflozíne nebolo pozorované. Výsledky CVOT štúdie s dapagliflozínom DECLARE-TIMI 58 zatiaľ nie sú známe, pretože štúdia ešte prebieha.
Okrem RCT štúdií sú k dispozícii výsledky RWE (Real World Evidence) štúdie CVD REAL z klinickej praxe, ktoré podporili výsledky RCT štúdií v zmysle redukcie celkovej mortality a redukcie potreby hospitalizácií pre srdcové zlyhávanie a kde boli zaradené všetky tri aktuálne používané účinné látky (dapagliflozín, empagliflozín, kanagliflozín). No uvažovať o „class“ efekte skupiny gliflozínov je zatiaľ predčasné, hoci niektoré efekty, menovite efekt na srdcové zlyhávanie a nefroprotektivita, sa javia ako podobné. Rozdiely sú v spektre a intenzite účinkov, ale tiež v nežiaducich účinkoch, a jednotlivé účinné látky treba hodnotiť individuálne. V tomto zmysle vyznieva zatiaľ aj väčšina referenčných terapeutických odporúčaní (ADA/EASD, CEEDEG) vrátane odporúčaní SDS.
Odporúčanie SDS s ohľadom na poznatky EBM a SPC favorizujú gliflozíny (preferenčne empagliflozín) v celom spektre liečby DM2T, s rešpektovaním platného indikačného obmedzenia pre hradenú liečbu, ktoré zatiaľ umožňuje ich využitie iba do trojkombinácie s metformínom a so sulfonylureou a do kombinácie s inzulínom a metformínom. U pacientov, ktorí už prekonali KV-príhodu, alebo majú príznaky či prejavy srdcového zlyhávania, alebo nefropatiu, sa liečba empagliflozínom odporúča dôrazne s cieľom redukovať mortalitné dôsledky a progresiu chronického renálneho poškodenia (schéma 6.3.1–3). Indikácia liečby však vždy musí zohľadňovať aj riziká a nežiaduce účinky.
Schéma 6.3 | Klinické kategórie pre výber vhodnej farmakologickej liečby DM2T v zmysle EBM dôkazov




Pôvodná obava z výskytu uroinfekcií sa neukázala ako zásadný klinický problém. Je však potrebné na túto komplikáciu myslieť. Výskyt genitálnych infekcií, hlavne kandidovej etiológie, bol však signifikantne zvýšený, a to viac u žien. Opatrnosť pri liečbe gliflozínmi je potrebná aj u pacientov so sklonom k dehydratácii a jej následkom a pravdepodobne tiež u pacientov po cievnej mozgovej príhode (CMP), hoci SPC takúto obavu priamo neuvádza. SGLT2 inhibítory sa nemajú začať podávať pacientom s eGFR < 60 ml/min/1,73 m2). Pri empagliflozíne, resp. kanagliflozíne, ak sa už podával, možno pokračovať v liečbe až do eGFR 45 ml/min/1,73 m2 v dávke nepresahujúcej 10 mg, resp. 100 mg. U niektorých pacientov bola opísaná tzv. euglykemická diabetická ketoacidóza. Jej výskyt pravdepodobne súvisel s nesprávnou indikáciou inhibítorov SGLT2 pacientom s diabetes mellitus 1. typu (DM1T), resp. nepoznaným latentným autoimuntným diabetom (LADA). Za potenciálne spúšťacie mechanizmy sa považuje interkurentné ochorenie, dehydratácia, chirurgický zákrok, stres, znížený príjem potravy a tekutín, redukcia dávok inzulínu, nízka funkčná rezerva B-buniek, zvýšené nároky na inzulín, požitie alkoholu. Využívanie iSGLT2 v klinickej praxi je na Slovensku zatiaľ veľmi nízke a nezodpovedá terapeutickej hodnote ani indikačným obmedzeniam. Silné dôkazy o ich morbiditno-mortalitnom benefite však túto situáciu už začínajú meniť.
6.2.6 PPARγ-agonisty – tiazolidíndióny, glitazóny (tab. 6.6)
PPARγ-agonisty sú diskutovanou skupinou perorálnych antidiabetík, ktoré sa po úvodnej obľube v posledných rokoch z klinickej praxe vytratili. Dôvodom boli nepriaznivé ukazovatele rizika KV-morbidity a mortality v metaanalýze výsledkov rosiglitazónu (štúdie DREAM, ADOPT) a niekoľko menších štúdií. Na druhej strane, viaceré analýzy štúdií s pioglitazónom u vysokorizikových pacientov s DM2T poukázali na mnohé potenciálne prínosy (sekundárna prevencia IM a akútneho koronárneho syndrómu u pacientov s predošlým IM, sekundárna prevencia CMP u pacientov s predošlou CMP, redukcia mortality pacientov na hemodialýze, redukcia prejavov zápalu pri nealkoholovej steatohepatitíde, redukcia rizika hepatocelulárneho karcinómu), ktoré však zostávajú v tieni zvýšeného rizika srdcového zlyhávania (pre ktoré FDA pri glitazónoch uvádza bezpečnostné varovanie, tzv. „black box“), zlomenín kostí a podozrenia na zvýšené riziko karcinómu močového mechúra. Zvýšené riziko srdcového zlyhávania (SZ) a tvorba edémov súvisí s retenciou sodíka a vody, ku ktorým glitazóny vedú.
Riziko karcinómu močového mechúra sa podľa novších údajov nepotvrdilo a očakávala sa „rehabilitácia“ pioglitazónu, ku ktorej však zatiaľ oficiálne nedošlo. V našom terapeutickom odporúčaní pioglitazón síce zostal súčasťou terapeutickej schémy, podobne ako v odporúčaniach ADA/EASD, v súčasnosti ho však v dôsledku bezpečnostných obáv nepovažujeme za preferovaný terapeutický výber. V roku 2014 na Slovensku užívalo pioglitazón asi 1,5 % pacientov s DM2T.

6.2.7 Inzulín (tab. 6.7)
U pacientov s DM2T je liečba inzulínom prirodzenou potrebou v dôsledku vývoja ochorenia, s postupným ubúdaním vlastnej sekrécie inzulínu. Hoci sa vlastná sekrécia dostáva u týchto pacientov pod hranicu, ktorú ešte považujeme za normálnu, iba výnimočne, relatívny nedostatok inzulínu k stupňu inzulínovej rezistencie sa objavuje už aj v skorších štádiách ochorenia. Kým je však potreba substitučnej liečby inzulínom v štádiu jeho nedostatku prirodzená, diskutovanou otázkou zostáva liečba inzulínom v skorších štádiách alebo dokonca už v čase diagnózy DM2T ako úvodnej liečby.
Inzulín je prirodzená a telu vlastná látka a liečba inzulínom je najstaršou a najdlhšie používanou liečbou diabetu. Zohráva úlohu pri raste, diferenciácii a regenerácii B-buniek, podporuje ich prežívanie a šetrí vlastnú sekréciu inzulínu. Spomaľuje progresiu dysfunkcie B-buniek a u pacientov s prediabetickým stavom (porucha tolerancie glukózy, hyperglykémia nalačno) viedol k oddialeniu začiatku diabetu. Inzulín tiež prejavuje celý rad potenciálnych vaskulárnych benefitov, ako sú antiinflamačné a antioxidačné účinky. Tie zahŕňajú supresiu NFκB (nukleárny faktor kappa B), E-selektínu, NADPH oxidázy, MCP1 (chemoatrakčný proteín monocytov), CRP (C-reaktívny proteín), supresiu tvorby reaktívnych foriem kyslíka (ROS), expresie adhezívnych molekúl či antiapoptotický efekt. Inzulín má aj antitrombotický efekt, indukuje expresiu NO-syntázy v endotelových bunkách, čo vedie k zvýšenej tvorbe NO (oxid dusnatý) a vazodilatácii, znižuje koncentráciu PAI-1 (inhibítor aktivátora plazminogénu 1) TF (tkanivový faktor) a stimuluje klonogénny potenciál angiogénnych endotelových progenitorových buniek. Inzulín tiež môže podporovať preferenčné využívanie glukózy, zdroja energie menej náročného na kyslík, v myokarde, pred využívaním mastných kyselín a zlepšovať funkciu dysfunkčného myokardu. Intenzívna liečba inzulínom sa v porovnaní s konvenčnou liečbou spája aj so signifikantne nižšími hladinami pokročilých glykačných produktov (advanced glycation end-products – AGE), ktoré okrem iného poškodzujú DNA mitochondriálnych respiračných proteínov, čo môže byť jedným z mechanizmov uplatňujúcich sa v procesoch metabolickej pamäti. Z hľadiska KV-rizika/benefitu je inzulín neutrálny a bezpečný aj zo stránky onkologického rizika. Priamy efekt inzulínu na výskyt a dôsledky makrovaskulárnych komplikácií v kompozitnom cieli zloženom z KV-úmrtia, nefatálneho infarktu myokardu a cievnej mozgovej príhody v štúdii ORIGIN nebol dokázaný. Hoci v subanalýzach došlo k signifikantnej redukcii nových prípadov anginy pectoris (efekt sa však vytratil vo „follow up“ štúdii ORIGINALE) a v predĺženej subštúdii GRACE došlo k nesignifikantnej redukcii hrúbky a. carotis intima media v primárnom cieli a signifikantnej redukcii a. carotis communis a bifurkácie v sekundárnom cieli, čo naznačuje možný priaznivý efekt na progresiu aterosklerotického postihnutia, efekt inzulínu na KVO sa považuje za neutrálny.
Nevýhody liečby inzulínom pre pacienta spočívajú vo väčšej náročnosti na spoluprácu, pravidelnom podávaní inzulínu, dodržiavaní diétnych a režimových opatrení, častejšom selfmonitoringu glykémií, v potrebe opakovanej titrácie dávky, v dôkladnom zladení režimu so životným štýlom a zamestnaním a ďalších. Liečba inzulínom sa mnohokrát neprijateľne odsúva. Podľa viacerých údajov v literatúre, ale aj podľa výsledkov nedávnej štúdie Insula T2 bola priemerná hodnota HbA1c pri iniciácii liečby inzulínom u pacientov s DM2T > 9,5 %, pričom u mnohých pacientov takýto stav pretrvával aj niekoľko rokov. Nežiaducim účinkom je prírastok na hmotnosti, riziko hypoglykémie, retencia sodíka a tekutín.

6.3 Možnosti liečby inzulínom u pacientov s DM2T
Možnosti a indikácie liečby inzulínom u pacientov s DM2T možno rozdeliť do niekoľkých skupín:
- iniciálna liečba DM2T pri veľmi vysokých hodnotách glykémie, resp. HbA1c, v čase diagnózy ochorenia
- iniciálna liečba s cieľom dosiahnuť remisiu ochorenia
- včasná liečba inzulínom v kombinácii s metformínom, pri nedostatočnom efekte liečby metformínom samotným
- intenzifikácia liečby do kombinácie so všetkými skupinami perorálnych a injekčne aplikovaných antidiabetík podávaných v monoterapii, dvojkombinácii alebo trojkombinácii
- ako koncová liečba po zlyhaní liečby neinzulínovými antidiabetikami
- liečba inzulínom ako voľba za špecifických okolností (renálna insuficiencia, hepatálna insuficiencia, intolerancia alebo kontraindikácia iných terapeutických možností)
6.3.1 Iniciálna liečba DM2T pri veľmi vysokých hodnotách glykémie, resp. HbA1c, v čase diagnózy ochorenia
Liečba inzulínom ± perorálnym antidiabetikom (PAD) sa ako úvodná liečba odporúča pacientom s novodiagnostikovaným DM2T s HbA1c > 10 %, alebo pri glykémiách > 14 mmol/l nalačno a/alebo > 16 mmol/l, kedykoľvek v priebehu dňa, alebo s klinickými prejavmi hyperglykémie (polyúria, polydipsia), alebo katabolizmu (úbytok hmotnosti, ketonúria, ketoacidóza), alebo pri nejasnej vstupnej klasifikácii diabetu, keď nemožno vylúčiť DM1T (LADA), či iný deficit sekrécie inzulínu (ochorenie pankreasu). Po úvodnej liečbe inzulínom u väčšiny pacientov sa stav obvykle pomerne rýchlo zlepší do tej miery, že možno pokračovať v liečbe PAD alebo dokonca u niektorých pacientov postačujú diétne a režimové opatrenia. Pri iniciácii liečby sa najčastejšie využíva bazálny inzulín v jednom dennom podaní večer pred spaním podľa všeobecných pravidiel, ktoré sú uvedené v ďalšom texte a na schéme 6.4. Indikačné obmedzenia v tejto indikácii však umožňujú podávať ako hradenú liečbu iba humánny inzulín v liekovke, ktorý nepodlieha indikačnému obmedzeniu, s aplikáciou pomocou inzulínových striekačiek. Ak by sa ukázala potreba dlhodobej (trvalej) liečby inzulínom a naplnia sa podmienky IO (liečba minimálne jedným PAD v maximálne tolerovanej dávke, resp. objavovali by sa hypoglykémie), je možný prechod na bazálny analóg inzulínu. Režim s viacerými podaniami inzulínu vrátane kompletnej substitučnej liečby bazálnym a prandiálnym inzulínom je vhodné uvážiť ako iniciálnu liečbu v prípade novozisteného DM2T s veľmi vysokými hodnotami glykémií a HbA1c (> 11 %). Takého pacienta je vhodné hospitalizovať, keďže okrem samotného nastavenia liečby je potrebné, aby čo najskôr zvládol celý rad edukačných tém, technických zručností a základných vyšetrení na prítomnosť komplikácií. Rozhodnutie v prospech hospitalizácie podporuje aj prítomnosť komorbidít, klinických prejavov a dôsledkov glukotoxicity dlhšie trvajúcej hyperglykémie, vyšší vek, horšie sociálne charakteristiky pacienta a mentálne prejavy a schopnosti naznačujúce pravdepodobnosť horšej úrovne spolupráce.
6.3.2 Iniciálna liečba s cieľom dosiahnuť remisiu ochorenia
V literatúre je niekoľko prác, ktoré ukázali, že ak sa liečba inzulínom začne dostatočne včas po prepuknutí ochorenia a dosiahne sa pomocou nej prakticky normalizácia glykémií, môže viesť k remisii ochorenia, ktorá pretrvávala aj po 2 rokoch u viac ako 50 % pacientov. Najpreukázanejší efekt bol zistený u pacientov, ktorým sa inzulín podával pomocou CSII (inzulínovej pumpy) a u ktorých sa dosiahla aj najlepšia glykemická kontrola. Liečba inzulínom bola pritom iba prechodná v trvaní 2–3 týždne, s dosiahnutím úpravy glykémií v priebehu 2–14 dní. Takýto postup však zatiaľ nie je v odporúčaniach preferovanou stratégiou, a to najmä z dôvodu ekonomickej náročnosti, ale aj nedostatku údajov z dlhšieho sledovania.
6.3.3 Včasná liečba inzulínom v kombinácii s metformínom, pri nedostatočnom efekte liečby metformínom samotným
Inzulín je „farmakom“ s najsilnejším potenciálom redukcie glykémie a cieľové hodnoty HbA1c sa v porovnaní s neinzulínovými antidiabetikami dosahujú vo väčšom podiele pacientov. Pridanie inzulínu k metformínu je jednou zo stratégií intenzifikácie liečby metformínom, uvádzaných referenčnými aj národnými štandardnými odporúčaniami vrátane odporúčaní SDS. Podstata včasnej liečby inzulínom je založená na dôkaze viacnásobných benefitov vrátane eliminácie glukotoxického efektu hyperglykémie, čím sa dosahuje navodenie funkčného pokoja B-buniek, šetrenie masy B-buniek a tiež zlepšenie citlivosti tkanív na inzulín. V štúdii ORIGIN s inzulínom glargín skorá iniciácia liečby (t. j. ešte pred progresívnou stratou B-buniek) bola z hľadiska dlhodobého účinku efektívnejšia než substitučná liečba v neskorších štádiách a umožňovala dosiahnuť dlhodobú (> 6 rokov trvajúcu) normalizáciu glykémií, pri relatívne nízkych dávkach inzulínu a nízkom riziku hypoglykémie. Je známe, že dosiahnutie intenzívnej glykemickej kontroly v skorých štádiách DM2T poskytuje prostredníctvom metabolickej pamäti aj dlhodobú ochranu pred progresiou komplikácií. Štúdia UKPDS u pacientov s novodiagnostikovaným DM2T poukázala na benefit intenzívnej liečby inzulínom, ktorá sa už počas kontrolovanej intervencie prejavila v jednoznačnej redukcii mikrovaskulárnych komplikácií a v následnom období sledovania aj v redukcii infarktu myokardu a KV-mortality u tých pacientov, u ktorých sa počas kontrolovanej intervencie dosiahla intenzívna glykemická kontrola. Tento tzv. „legacy“ efekt sa pri liečbe inzulínom vysvetľuje okrem iného redukciou tvorby AGE vplývajúcich na funkcie mitochondrií (ale aj iných celulárnych štruktúr a funkcií), ktoré sú zrejme ireverzibilné.
Pre preferenčnú liečbu bazálnym inzulínom do kombinácie s metformínom sa v klinickej praxi obvykle ešte stále rozhodujeme najmä u pacientov s vyššími vstupnými glykémiami, resp. s HbA1c presahujúcim cieľovú hodnotu o viac ako 1,5–2 %, pri úbytku hmotnosti, pri podozrení na diabetes mellitus typu LADA, pri dominancii hyperglykémií nalačno a preprandiálnych hyperglykémií. Avšak z pohľadu aktuálnej filozofie liečby je včasná liečba inzulínom preferovaná najmä z dôvodu, že spomaľuje progresiu dysfunkcie B-buniek, a tak ponúka zásadný patofyziologický benefit. Umožňuje dosiahnuť dlhodobú optimalizáciu kontroly glykémií a vedie tiež k zlepšeniu odpovede aj na inú následnú, resp. paralelnú antidiabetickú liečbu. Navyše, včasná kombinácia bazálneho inzulínu s metformínom vytvára v súlade s IO aj širokú bázu umožňujúcu následné využitie všetkých ostatných účinných látok vrátane najnovších, ako je iSGLT2 a aGLP1R. Preferovanou voľbou sú bazálne analógy inzulínu, ktoré k tejto voľbe prispievajú bezpečnejším dosiahnutím intenzívnych kritérií glykemickej kontroly, a v prípade bazálnych analógov glargín a degludek aj KV a onkologickou bezpečnosťou potvrdenou v RCT štúdiách. Naopak, na neprospech liečby inzulínom môže poukazovať progresívny prírastok na hmotnosti, výrazná obezita, sklon k hypoglykémiám či predpoklad zlej spolupráce pacienta. Preferujú sa bazálne analógy inzulínu (umožňuje to aj IO), ako je inzulín glargín 100 U/ml, inzulín glargín 300 U/ml, inzulín detemir či inzulín degludek v jednom dennom podaní, obvykle večer pred spaním. Pravidlá iniciácie, titrácie a intenzifikácia liečby sú uvedené v ďalšom texte a na schéme 6.4.
6.3.4 Intenzifikácia liečby do kombinácie so všetkými skupinami perorálnych a injekčne aplikovaných antidiabetík podávaných v monoterapii, 2-kombinácii alebo 3-kombinácii
Inzulín možno kombinovať so všetkými ostatnými farmakami vrátane novších molekúl, a to pri dodržaní príslušných podmienok stanovených indikačným obmedzením pre liečbu hradenú zo zdravotného poistenia. Pri kombinovanej liečbe s perorálnymi antidiabetikami sa obvykle ponecháva metformín, zatiaľ čo pri prípravkoch sulfonylurey je potrebné uvážiť ich vysadenie. Kombinácia inzulínu s gliptínmi je možná buď samostatne, alebo v súčasnej trojkombinácii s metformínom. Iné antidiabetikum do trojkombinácie s gliptínom a inzulínom nemožno použiť. Pre kombináciu inzulínu s gliflozínmi sa v indikačnom obmedzení zatiaľ vyžaduje súčasná liečba metformínom. Iné antidiabetikum do trojkombinácie s iSGLT2 a inzulínom podľa znenia IO nemožno použiť. Súčasnú liečbu inzulínom a aGLP1R indikačné obmedzenia zatiaľ umožňuje iba v prípade, ak sa aGLP1R pridáva k bazálnemu inzulínu, nie v opačnom poradí. Aj v tomto prípade je však možné iba využitie fixnej kombinácie inzulínu degludek a liraglutidu.
6.3.5 Koncová liečba po zlyhaní liečby neinzulínovými antidiabetikami
Doposiaľ ide asi o najčastejšie využitie inzulínu u pacientov s DM T. Inzulín ako najpotentnejšie antidiabetikum dokáže upraviť glykémiu aj pri stavoch, keď iné spôsoby už nedokážu udržať adekvátnu glykemickú kontrolu. Aj v tomto prípade sa obvykle začína bazálnym inzulínom s preferenciou bazálnych analógov. Ak sa však liečba inzulínom začína neskoro, často sú potrebné aj komplexnejšie režimy vrátane kompletnej substitučnej liečby bazálnym aj prandiálnym inzulínom (schéma 6.4).

6.3.6 Liečba inzulínom ako voľba za špecifických okolností (renálna insuficiencia, hepatálna insuficiencia, intolerancia alebo kontraindikácia iných terapeutických možností)
Analógy inzulínu (bazálne aj prandiálne), tab. 6, majú výhodnejšie farmakokinetické vlastnosti, čo je aj dôvod na ich preferenciu. Pri bazálnych analógoch sa tieto výhody v klinickej praxi prejavujú v predĺženom účinku, nižšom výskyte hypoglykémie (obzvlášť nočnej), nižšej variabilite účinku a vo vyššom podiele pacientov, ktorí dosiahli požadované kritériá liečby bez hypoglykémie, v nižšom prírastku na hmotnosti a vo väčšej flexibilite podávania. Tieto výhody sú zrejmé najmä pri inzulíne degludek a pri inzulíne glargín 300 U/ml, čo sú inzulíny s najnižším rizikom hypoglykémie, najnižšou variabilitou účinku a potvrdenou KV aj onkologickou bezpečnosťou.
Najčastejším spôsobom iniciácie liečby inzulínom je podávanie bazálneho inzulínu (schéma 6.4). Ak to dovoľuje IO, preferovanou voľbou sú bazálne analógy: glargín 100 U/ml, resp. glargín 300 U/ml, detemir alebo degludek. Znenie IO je pre bazálne analógy pomerne ústretové a vyžaduje predošlú liečbu minimálne jedným perorálnym antidiabetikom v maximálne tolerovanej dávke. Alternatívnym iniciálnym režimom pri HbA1c > 8,5 % je režim s bifázickým inzulínom, opäť s preferenciou analógov (schéma 6.4).
Iniciálna dávka pri liečbe bazálnym inzulínom je 0,1–0,15 U/ kg telesnej hmotnosti (TH) s titráciou o ± 1–2 U/deň s frekvenciou 1–2-krát v týždni, podľa priemeru glykémie nalačno (FPG) za predošlé 3 dni, a to až do dosiahnutia požadovanej glykemickej kontroly, resp. do dosiahnutia cieľovej hodnoty FPG, resp. celkovej dennej dávky 0,5 U/kg, TH. Po dosiahnutí tejto dávky už efektivita titrácie bazálneho inzulínu obvykle výrazne klesá a zvyšuje sa riziko nežiaducich účinkov. Ak však pacient aj pri dosiahnutí tejto dávky naďalej odpovedá bezpečnou a adekvátnou úpravou glykémií, možno v titrácii pokračovať.
Dávka bazálneho inzulínu u pacientov s DM2T na Slovensku sa podľa prieskumu FUTURE z roku 2010 javila ako výrazne nedotitrovaná. Priemerná dávka bazálneho inzulínu ± PAD u pacientov s priemerným HbA1c 8,7 % v čase intenzifikácie prandiálnym inzulínom predstavovala iba 25 U/deň (0,25 U/kg.TH).
Intenzifikácia liečby bazálnym inzulínom po dosiahnutí hranice efektívnej titrácie bola donedávna možná iba pridaním prandiálneho inzulínu (schéma 6.4), pričom za preferované sa opäť považujú prandiálne analógy inzulínu (aspart, glulizín, lispro) vzhľadom na lepšiu kontrolu postprandiálnych glykémií a nižšie riziko hypoglykémie. V súčasnosti možno využívať už aj kombináciu bazálneho inzulínu s aGLP1R ako hradenú liečbu v súlade s IO, zatiaľ však iba vo forme fixnej kombinácie inzulínu degludek a aGLP1R liraglutid (iDegLira). EBM potvrdenú efektivitu a bezpečnosť preukázala aj liečba v kombinácii inzulínu glargín a lixisenatidu, kde rovnako ako pri iDegLira liečba viedla k porovnateľnému poklesu HbA1c, avšak s nižším výskytom hypoglykémií a prírastku na hmotnosti, než pri pridaní 1–3 prandiálnych bolusov. Na Slovensku však zatiaľ táto kombinácia nie je liečbou hradenou zo zdravotného poistenia.
6.3.7 Diabetes špecifické nutričné produkty
Diabetes špecifické nutričné produkty (DŠNP), presnejšie nutričné produkty špecifické pre diabetes, sú súčasťou mnohých národných terapeutických odporúčaní pre liečbu diabetes mellitus. DŠNP sú terapeutické (nie roboračné) nutričné prípravky, ktoré boli vyvinuté s cieľom podporiť liečbu diabetes mellitus. Majú nízky glykemický index, čo sa dosahuje ich zložením, keď pri rovnakej kalorickej hodnote majú nižší obsah sacharidov a vyšší obsah MUFA (mononenasýtené mastné kyseliny). Používajú sa ako ekvikalorická náhrada časti dennej potravy na redukciu postprandiálnej glykémie, glykemickej variability, na zníženie HbA1c, redukciu výskytu hypoglykémií a redukciu telesnej hmotnosti. Pri liečbe dochádza tiež k poklesu TK a úprave lipidov a zápalových parametrov.
6.3.8 Ostatné farmaká využívané v liečbe diabetes mellitus 2. typu
6.3.8.1 Deriváty meglitinidu (glinidy), repaglinid, nateglinid (tab. 6.2)
Účinkom aj nežiaducimi účinkami sú podobné prípravkom sulfonylurey. Účinok je rýchlejší a krátkodobejší. Majú akcentovaný efekt na kontrolu postprandiálnej glykémie, no so zvýšeným rizikom hypoglykémie a prírastku na hmotnosti. Kým u pacientov bez predošlej KV-príhody sú z hľadiska KV-rizika neutrálne, u pacientov s prekonanou KV-príhodou riziko skôr zvyšujú.
6.3.8.2 Inhibítory alfa-glukozidázy (akarbóza, miglitol)
Znižujú vstrebávanie sacharidov v čreve. Majú akcentovaný efekt na postprandiálnu glykémiu. Výhodou je nízke riziko hypoglykémie, hmotnostná neutralita a potenciálny benefit v zmysle redukcie výskytu KV-príhod (STOP-NIDDM). Nevýhodou sú pomerne časté a výrazné gastrointestinálne nežiaduce účinky.
6.3.8.3 Bromokryptín
Je súčasťou liečby DM2T podľa odporúčania ADA/EASD aj Americkej asociácie klinických endokrinológov (AACE). FDA ho pre indikáciu v liečbe DM2T schválila v roku 2009. Bromokryptín pravdepodobne účinkuje na cirkadiánnu neuronálnu aktivitu v hypotalame, čím ovplyvňuje hypotalamickú reguláciu metabolizmu. Zvyšuje dopaminergnú aktivitu, znižuje sympatikovú a sérotoninergnú aktivitu. Potláča hepatálnu produkciu glukózy, zlepšuje citlivosť na inzulín, znižuje hladiny triglyceridov. Prispieva k poklesu HbA1c o 0,4–0,8 % bez rizika hypoglykémie, vedie k poklesu telesnej hmotnosti. Medzi nežiaduce účinky patrí závrat, slabosť, nauzea, rinitída. Efekt bromokryptínu na KV-príhody bol testovaný v štúdii Cycloset Safety Trial, ktorá trvala 52 týždňov a randomizovaných bolo 3 095 pacientov s DM2T. Riziko KV-príhod (kombinovaný KV-ukazovateľ – nefatálny IM, nefatálna CMP, koronárna revaskularizácia, hospitalizácia v dôsledku nestabilnej anginy pectoris alebo kongestívneho srdcového zlyhávania) sa pri liečbe bromokriptínom znížilo počas jedného roka o 40 % vs placebo (HR 0,60; 95% CI 0,35–0,96). Ak bola následne zahrnutá aj KV-mortalita do kombinovaného KV-ukazovateľa, pretrvávalo 39% zníženie KV-rizika. V súčasnosti nie je stabilnou súčasťou odporúčania SDS.
6.3.8.4 Kolesevelam
Kolesevelam je sekvestrant žlčových kyselín druhej generácie, ktorý prejavuje efekt tak na hladiny glykémie, ako aj lipidov. Efekt na glykémiu sa vysvetľuje supresiou hepatálnej produkcie glukózy a vzostupom hladín inkretínov. Výhodou je, že nevedie k hypoglykémii a súčasne znižuje hladinu LDL-cholesterolu. Nevýhodou je relatívne malý efekt na HbA1c, zápcha a vzostup triglyceridov. Podobne ako bromokryptín je už aj súčasťou terapeutického algoritmu pre liečbu DM2T ADA/EASD aj Americkej asociácie klinických endokrinológov (AACE) v kombinácii s metformínom, sulfonylureou alebo inzulínom. FDA ho na indikáciu v liečbe DM2T schválila v roku 2008. Zatiaľ nie je stabilnou súčasťou odporúčania SDS.
6.3.8.5 Amylínové mimetiká
Pramlintid aktivuje amylínové receptory. Potláča sekréciu glukagónu. Mimetiká spomaľujú vyprázdňovanie žalúdka a zvyšujú pocit sýtosti. Znižujú postprandiálnu glykémiu a telesnú hmotnosť. Medzi nežiaduce účinky patrí nauzea, hypoglykémia. Zatiaľ nie sú stabilnou súčasťou odporúčania SDS.
6.4 Terapeutický algoritmus DM2T v súlade s SPC, so znením IO a s aktuálnou filozofiou pre výber liečby
Schéma 2 uvádza všetky aktuálne terapeutické „cesty“, ktoré sú v súlade s SPC a IO. Schéma 6.3.1–3 uvádza odporúčané preferenčné výbery účinných látok podľa charakteristík pacienta a EBM dôkazov benefitov/rizík jednotlivých účinných látok.
Základné a trvalé požiadavky: edukácia pacienta, spolupráca pacienta, adherencia pacienta k liečbe, realizácia liečby a vyšetrení odporúčaných lekárom, adekvátna fyzická aktivita, racionálna výživa, redukcia nadváhy/obezity, eliminácia stresu a fajčenia.
6.4.1 Iniciálna monoterapia
Za preferovaný výber iniciálnej farmakologickej liečby sa zatiaľ stále považuje metformín, hoci v poslednom čase túto pozíciu viacerí autori prehodnocujú v prospech aGLP1R a tiež inzulínu. Odporúčanou alternatívou pri kontraindikácii alebo intolerancii metfomínu, ktorú umožňuje IO pre hradenú liečbu, je gliptín alebo sulfonylurea (preferenčne gliklazid MR). Možnou alternatívou je tiež pioglitazón. Za určitých okolností (intolerancia, nefropatia, hepatopatia s kontraindikáciou PAD), obzvlášť však pri veľmi neuspokojivej glykemickej kontrole v období diagnózy (vstupný HbA1c > 10 %, alebo HbA1c > 9 % s klinickými prejavmi hyperglykémie, alebo pri glykémiách > 14–16 mmol/l sprevádzaných klinickými prejavmi, ako je polyúria, polydipsia a ďalšie sa ako preferovaná iniciálna liečba uplatňuje inzulín ± PAD. Pre hradenú liečbu zo zdravotného poistenia však v tomto prípade možno liečbu začať iba humánnym inzulínom.
6.4.2 Kombinácia dvoch antidiabetických farmák
Kombinácia dvoch druhov perorálnych antidiabetík (PAD) alebo PAD a GLP-1R, alebo PAD a inzulínu sa obvykle využíva pri nedostatočnom účinku monoterapie. Pri vstupných hodnotách HbA1c > 9 % v čase diagnózy DM2T však možno dvojkombináciu použiť aj ako iniciálnu liečbu. Indikačné obmedzenie v takomto prípade umožňuje iba kombináciu metformínu so sulfonylureou, kde preferovaným prípravkom sulfonylurey je gliklazid MR.
Pri nedostatočnom efekte metformínu v monoterapii možno do dvojkombinácie pridať zástupcu akejkoľvek inej skupiny PAD (s výnimkou iSGLT2, nakoľko takúto dvojkombináciu zatiaľ neumožňuje indikačné obmedzenie – IO) alebo aGLP1R, alebo inzulín, preferenčne bazálny analóg (schéma 6.2). V súlade s SPC a IO sa za aktuálne možnú dvojkombináciu považuje metfomín s gliptínom, metformín so sulfonylureou (preferenčne gliklazid MR), metformín s aGLP1R, metformín s inzulínom (preferenčne bazálny analóg) a možná je tiež kombinácia metformínu s glitazónom. Konkrétny výber závisí od príslušných okolností, predovšetkým od medicínskych charakteristík pacienta. V súvislosti s najnovšími poznatkami a výsledkami CVOT štúdií je jednou z kruciálnych otázka, či pacient trpí aterosklerotickým KVO (vrátane ochorení periférnych artérií), či prekonal KV-príhodu (infarkt myokardu, cievna mozgová príhoda), alebo má prejavy alebo znaky srdcového zlyhávania (SZ), alebo sú prítomné prejavy nefropatie. Ak pacient spadá do takejto kategórie, preferovaným postupom (s ohľadom na kontraindikácie) je pridanie aGLP1R, konkrétne liraglutidu, alebo iSGLT2 (gliflozínu), konkrétne empagliflozínu. Ak pacient má prejavy alebo znaky SZ, je voľba gliflozínu považovaná za preferovaný postup. Aktuálne je však použitie gliflozínu v dvojkombinácii s metformínom na Slovensku limitované indikačným obmedzením.
Z praktického hľadiska a v súlade s SPC, EBM, ako aj IO za optimálny výber kombinácie k metformínu, obzvlášť ak ide o pacienta so zvýšeným KV-rizikom, prekonaným KV-ochorením alebo s nefropatiou považujeme kombináciu metformínu s aGLP1R. Za preferovanú účinnú látku z hľadiska EBM dôkazu redukcie KV-morbidity a mortality sa považuje liraglutid, pri ktorom sa uvažuje, že by mohol spomaľovať progresiu aterogenézy. Argumentom preferencie aGLP1R do kombinácie s metformínom je aj silný efekt na HbA1c pri nízkom riziku hypoglykémie, redukcia telesnej hmotnosti a priaznivý efekt na viaceré KV-rizikové faktory (krvný tlak, krvné lipidy, chronický subklinický zápal).
Keďže dvojkombináciu metformínu s gliflozínom zatiaľ ako hradenú liečbu indikačné obmedzenie neumožňuje, u pacientov s prekonanou KV-príhodou alebo s prejavmi srdcového zlyhávania odporúčame uvážiť túto kombináciu aj ako nehradenú liečbu so súhlasom pacienta. Najväčšiu šírku EBM dôkazov KV-benefitu má v súčasnosti empagliflozín, ktorý u pacientov s vysokým KV-rizikom viedol k významnej redukcii kardiovaskulárnej aj celkovej mortality a znižoval mortalitu a potrebu hospitalizácií pre srdcové zlyhávanie. Uvažuje sa o viacúrovňovom priaznivom hemodynamickom a metabolickom efekte empagliflozínu na ischemický myokard.
6.4.2.1 Ďalšie možnosti, najmä u pacientov bez prítomnosti aterosklerotického kardiovaskulárneho ochorenia
kombinácia metformínu s gliptínom, čo je v súčasnosti veľmi populárny výber najmä vďaka hmotnostnej neutralite a minimálnemu riziku hypoglykémie, zatiaľ však bez dôkazu kardiovaskulárneho, renálneho, či mortalitného benefitu
kombinácia metformínu so sulfonylureou s preferenciou gliklazidu MR, ktorý má v porovnaní s inými prípravkami sulfonylurey dokázanú KV-bezpečnosť a nižšie riziko hypoglykémie; výhodou tejto dvojkombinácie je vytvorenie širokého priestoru pre neskoršie pridanie zástupcu akejkoľvek inej skupiny PAD, alebo aGLP1R alebo inzulínu, do trojkombinácie, zatiaľ čo pri iných dvojkombináciách sú možnosti limitované znením IO (schéma 6.2)
kombinácia metformínu s bazálnym inzulínom (podrobnejšie v časti Včasná liečba inzulínom v kombinácii s metformínom, pri nedostatočnom efekte liečby metformínom samotným); okrem pacientov s horšou glykemickou kontrolou je včasná liečba inzulínom v kombinácii s metformínom preferovaná najmä z dôvodu, že spomaľuje progresiu dysfunkcie B-buniek a ponúka tak zásadný patofyziologický benefit. Umožňuje dosiahnuť dlhodobú optimalizáciu kontroly glykémií a vedie tiež k zlepšeniu odpovede aj na inú následnú, resp. paralelnú antidiabetickú liečbu; navyše, v súlade s IO sa vytvára priestor umožňujúci následné, resp. paralelné, využitie všetkých ostatných účinných látok vrátane najnovších, ako sú iSGLT2 a aGLP1R. Preferovanou voľbou sú bazálne analógy inzulínu, umožňujúce bezpečnejšie dosiahnutie intenzívnych kritérií glykemickej kontroly, a v prípade bazálnych analógov glargín a degludek aj kardiovaskulárnu a onkologickú bezpečnosť
kombinácia metformínu s pioglitazónom (s ohľadom na možné KV-riziká)
6.4.2.2 Alternatívne dvojkombinácie pri intolerancii alebo kontraindikácii metformínu
- pri predošlej iniciálnej liečbe prípravkom sulfonylurey kombinácia s gliptínom alebo inzulínom, alebo glitazónom
- pri predošlej iniciálnej liečbe gliptínom kombinácia so sulfonylureou alebo s inzulínom
- pri predošlej iniciálnej liečbe glitazónom kombinácia so sulfonylureou alebo s inzulínom, alebo gliptínom (tu však vzhľadom k zneniu IO iba fixná kombinácia pioglitazónu + alogliptínu)
- pri predošlej iniciálnej liečbe bazálnym inzulínom kombinácia so sulfonylureou alebo s gliptínom alebo glitazónom, alebo aGLP1R (tu však vzhľadom k zneniu IO iba fixná kombinácia inzulínu degludek + liraglutid)
Indikačné obmedzenie zatiaľ ako hradenú liečbu neumožňuje ani vzájomnú kombináciu gliptínu s aGLP1R, ani s gliflozínom a neumožňuje ani vzájomnú kombináciu aGLP1R a gliflozínu.
6.4.3 Kombinácia troch neinzulínových antidiabetických farmák
Trojkombinácia je v súčasnosti všeobecne akceptovaným postupom pri liečbe DM2T, s predpokladom, že sa využívajú farmaká s účinkom na rôznych, resp. odlišných, úrovniach. Za základný pilier sa aj v tomto prípade zatiaľ považuje metformín. Hoci podľa referenčných medzinárodných odporúčaní ADA/EASD aj SPC sú možné prakticky všetky vzájomné kombinácie jednotlivých skupín perorálnych antidiabetík, aGLP1R alebo inzulínu, IO pre hradenú liečbu v súčasnosti umožňuje len tie trojkombinácie, ktorých súčasťou je metformín a prípravok sulfonylurey alebo metformín a inzulín. Jedinou výnimkou je trojkombinácia metformínu + fixná kombinácia pioglitazónu s alogliptínom. Táto kombinácia je však využiteľná len obmedzene, obzvlášť vzhľadom na riziko SZ u pacientov s KV-ochorením. Naopak, chýbajúcimi článkami (možnosťami) trojkominácie, ktoré sa odporúčajú aj v referenčných medzinárodných odporúčaniach (ADA/EASD) a odporúčaniach CEEDEG, no neumožňuje ich IO ako hradenú liečbu, je vzájomná kombinácia metformínu s gliflozínom a aGLP1R alebo kombinácia metformínu, gliflozínu a gliptínu.
V súlade s SPC a IO sa za možné trojkombinácie hradené z prostriedkov zdravotného poistenia považujú najmä:
Metformín a sulfonylurea s gliflozínom – efektívna liečba s nízkym rizikom hypoglykémie a redukciou telesnej hmotnosti. Výhodná u väčšiny pacientov s DM2T. Dôrazne odporúčaná a preferovaná je najmä u pacientov, ktorí už prekonali KV-príhodu, u pacientov s prejavmi srdcového zlyhávania, a u pacientov s prítomnou nefropatiou s cieľom redukcie kardiovaskulárnej a celkovej mortality a progresie nefropatie. Preferovaným gliflozínom je empagliflozín. Výsledky CVOT štúdie EMPA-REG Outcome s empagliflozínom (tab. 6.8) preukázali signifikantnú redukciu kardiovaskulárne aj celkovej mortality u pacientov s vysokým KV-rizikom, resp. po prekonaní KV-príhody, a redukciu potreby hospitalizácií a mortality pre srdcové zlyhávanie. Výsledky tiež preukázali signifikantnú redukciu progresie nefropatie. V CVOT štúdii CANVAS Program viedla liečba kanagliflozínom (tab. 6.8) k redukcii hospitalizácií pre srdcové zlyhávanie a k redukcii progresie nefropatie, nepreukázala však redukciu KV ani celkovej mortality. CVOT štúdia s dapagliflozínom zatiaľ nebola ukončená. Priaznivé KV-účinky gliflozínov v zmysle redukcie hospitalizácií pre srdcové zlyhávanie podporila aj štúdia CVD Real Study z reálnej praxe.
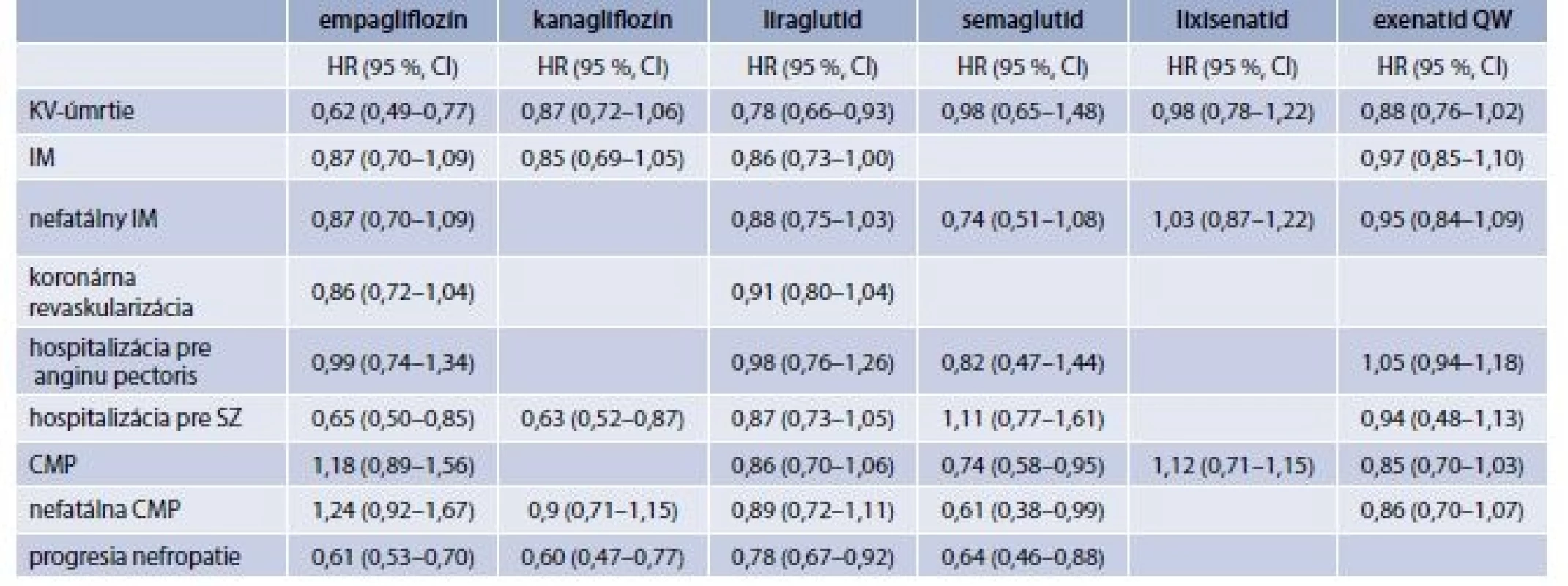
Táto trojkombinácia môže byť výhodná aj u pacientov s rizikom pankreatitídy či so spomaleným vyprázdňovaním žalúdka.
Metformín a sulfonylurea s aGLP1R je vhodná najmä pre pacientov s KV-ochorením, ale aj bez neho, a najmä s rizikom alebo po prekonaní cievnej mozgovej príhody, či s periférnym arteriálnym ochorením s cieľom redukcie KV-mortality a progresie nefropatie. Preferovaným aGLP1R je u týchto pacientov liraglutid. Štúdia LEADER (tab. 6.8) s liraglutidom preukázala signifikantnú redukciu mortality u pacientov s vysokým KV-rizikom, resp. po prekonaní KV-príhody, a hraničnú redukciu výskytu infarktu myokardu. Liečba liraglutidom v uvedenej štúdii tiež viedla k redukcii progresie nefropatie. Štúdia SUSTAIN-6 so semaglutidom preukázala redukciu výskytu cievnej mozgovej príhody, redukciu potreby revaskularizačných zákrokov na periférnych cievach, redukciu progresie nefropatie, nie však KV-mortality. Štúdia EXSCEL s exenatidom QW preukázala redukciu celkovej mortality, nie však KV-mortality a KV-príhod. Všetky uvedené štúdie tiež preukázali redukciu progresie nefropatie do vyšších štádií. Štúdia s lixisenatidom ELIXA preukázala neutrálny efekt na riziko KV-morbidity a mortality.
Metformín a sulfonylurea s gliptínom je vhodná kombinácia najmä pre pacientov so sklonom k hypoglykémii, dehydratácii, po cievnej mozgovej príhode, či so sklonom k infekciám urogenitálneho systému. Doterajšie CVOT štúdie s gliptínmi však nepriniesli presvedčivé výsledky o morbiditno-mortalitnom benefite. Naopak, v prípade saxagliptínu a čiastočne aj alogliptínu sa ukázalo zvýšené riziko srdcového zlyhávania.
Sitagliptín sa považuje z hľadiska KV-morbidity a mortality za neutrálny (štúdia TECOS) a stal sa preferovaným gliptínom aj v odporúčaniach SDS.
Pri kombináciách metformín, sulfonylurea, pioglitazón alebo metformín, alogliptín, pioglitazón je vždy potrebné najskôr uvážiť potenciálne riziká týchto kombinácií, predovšetkým riziko srdcového zlyhávania, preto ich nepovažujeme za preferované.
6.4.4 Liečba inzulínom v kombinácii s PAD alebo bez nich (schéma 4)
Za preferované kombinácie neinzulínových antidiabetík s inzulínom možno považovať metformín, gliptíny, sulfonylureu, iSGLT2, ako aj aGLP1R.
Za hradené trojkombinácie sa považujú inzulín a metformín so sulfonylureou alebo s gliptínom, alebo iSGLT2.
Pre hradenú liečbu pri kombinácii inzulínu s iSGLT2 vyžaduje IO súčasnú liečbu metformínom. Pre kombináciu inzulínu s aGLP1R vyžaduje IO predošlú liečbu bazálnym inzulínom a zatiaľ povoľuje iba fixnú kombináciu bazálneho inzulínu degludeku a aGLP1R liraglutidu. Ani IO nepovoľuje opačný postup, t. j. pridanie inzulínu k predošlej liečbe aGLP1R.
Pridanie aGLP1R k režimom komplexnej substitúcie bazálnym + prandiálnym inzulínom prostredníctvom fixnej kombinácie bazálneho inzulínu degludek a liraglutidu neuvádza v indikáciách SPC lieku.
6.5 Zásady pri rozhodovaní o výbere lieku a jeho preskripcii
Keďže základnou požiadavkou a súčasne pomerne častým problémom je správna klasifikácia DM, je potrebné v klinicky nejednoznačných prípadoch využívať dostupné markery na diferencovanie DM2T od DM1T, ako je hladina C-peptidu a autoprotilátky proti antigénovým štruktúram B-buniek pankreasu. Nesprávna klasifikácia môže viesť k zásadným omylom pri výbere zvolenej liečby, napríklad nevhodné použitie PAD (sulfonylurea, gliptíny, gliflozíny) namiesto inzulínu u pacientov s DM1T, resp. s latentným autoimunitným diabetom mellitom (LADA) s následným potenciálnym rizikom niektorých komplikácií (napr. diabetická ketoacidóza).
Pri indikácii (výbere) jednotlivých prípravkov lekár postupuje na základe svojej klinickej úvahy, pri ktorej by mal zohľadniť charakteristiky riešeného pacienta, ciele a možnosti liečby, ktoré sa chcú u konkrétneho pacienta dosiahnuť (tab. 6.7), a EBM poznatky nedávnych CVOT štúdií, ktoré poukázali na benefity/riziká jednotlivých farmák a postupov vrátane možnosti ovplyvnenia (redukcie) KV-morbidity a mortality pacientov s DM2T. Pri výbere liečby sa preto zohľadňuje najmä prítomnosť KVO, funkcia obličiek, vek, trvanie diabetu, schopnosť a vôľa pacienta spolupracovať, predošlá liečba, výskyt nežiaducich účinkov, riziko hypoglykémie, prírastok na hmotnosti, prítomnosť iných komorbidít, sociálno-ekonomické postavenie pacienta s ohľadom na doplatky za lieky a pod.
Terapeutický cieľ samotnej glykemickej kontroly (tab. 6.9) zohľadňuje nielen cieľovú hodnotu HbA1c, ale aj jednotlivé glykémie a ich variabilitu. Vo všeobecnosti u mladších pacientov na začiatku ochorenia, resp. s krátkym trvaním ochorenia (< 5–10 rokov) sa volia prísnejšie kritériá (HbA1c < 7 %, resp. < 6,5 %). Naopak, u starších polymorbídnych pacientov s dlhším trvaním ochorenia (> 15–20 rokov) sú kritériá obvykle voľnejšie (HbA1c 7,5–8 %). Intenzifikáciu liečby limituje a kritériá zvoľňuje najmä pokročilý vek, zlá spolupráca pacienta, riziko častých a závažných hypoglykémií aj závažné komorbidity limitujúce očakávanú dĺžku prežitia pacienta (tab. 6.8). Intenzívna glykemická kontrola redukuje progresiu mikrovaskulárnych komplikácií bez ohľadu na trvanie ochorenia a prítomnosť komplikácií. Okrem toho intenzívna glykemická kontrola, ak bola začatá v úvode ochorenia, z dlhodobého hľadiska prispieva k primárnej prevencii KV-príhod a sekundárnej prevencii nefatálneho IM aj u pacientov s vysokým KV-rizikom. Snaha o normalizáciu glykémií u pacientov s vysokým KV-rizikom však súčasne zvyšuje riziko úmrtia z akejkoľvek príčiny a srdcového zlyhávania. Vysvetlenie tejto asociácie nie je celkom jasné a nedá sa vysvetliť ani častejším výskytom hypoglykémií v intenzívne liečenej skupine pacientov. Normalizácia glykémie u pacientov s predtým dlhšie trvajúcou hyperglykémiou môže byť pre ischemický/zlyhávajúci a inzulinorezistentný myokard nevýhodná. Keďže utilizácia glukózy v myokarde je nedostatočná, nižšia hladina glykémie môže tento nedostatok ďalej akcentovať. Následná preferencia energetických súbstrátov s vyššími nárokmi na kyslík, ako sú voľné mastné kyseliny, situáciu ďalej komplikuje.

V poslednom čase v súvislosti s EBM poznatkami z nedávnych CVOT štúdií dochádza v myslení a výbere liečby k odklonu od doposiaľ silne glukocentrického prístupu, k prístupu zameranému na klinickú charakteristiku pacienta a k výberu farmakologickej liečby podľa EBM benefitov, ale aj rizík, a možností redukcie mortality, spomalenia progresie aterosklerotických KVO (ASKVO), zlepšenia prejavov srdcového zlyhávania, ktoré u pacientov s DM2T môže mať aj inú etiológiu než sú ASKVO, a tiež ovplyvnenia progresie nefropatie. Ak teda ide o pacienta s anamnézou KV-príhod, ASKVO, prejavmi srdcového zlyhávania či nefropatiou, potom by v liečbe mali byť využité aj farmaká s potvrdeným benefitom na uvedené komplikácie a ochorenia ako sú empagliflozín či liraglutid.
Sumárne, EBM poznatky z kľúčových štúdií poukazujú na dôležitosť intenzívnej glykemickej kontroly a zatiaľ stále preferenčný výber metformínu ako iniciálnej liečby u pacientov na začiatku ochorenia (a bez komplikácií), zatiaľ čo u pacientov s prekonaným KVO by mala byť glykemická kontrola voľnejšia (tab. 6.8), so zakomponovaním farmák s potvrdeným KV-benefitom, resp. benefitom redukujúcim mortalitné dôsledky KVO a príhod. Medzi takéto prípravky patria gliflozíny (zatiaľ najmä empagliflozín) a aGLP1R (zatiaľ najmä liraglutid).
Gliptíny a inzulín sú z hľadiska KV-morbidity a mortality považované skôr za neutrálne. Niektoré gliptíny (saxagliptín a čiastočne aj alogliptín) však môžu zvyšovať riziko srdcového zlyhávania, preto sa všeobecne preferujú tie, ktoré takéto riziko v CVOT štúdiách nepreukázali (zatiaľ iba sitagliptín).
Prípravky na báze sulfonylurey (s výnimkou gliklazidu MR) sú z hľadiska KV-morbidity a mortality považované skôr za rizikové a je všeobecný ústup od ich používania. Za rizikové, najmä z hľadiska rizika srdcového zlyhávania, sa považujú najmä glitazóny.
U pacientov s poruchou renálnych funkcií treba zohľadniť jednak možnosť použitia príslušného farmaka, jednak potenciálny benefit spomaľujúci progresiu nefropatie. Vhodnosť použitia jednotlivých farmák s ohľadom na renálne parametre uvádza schéma 6.3.2.
Jednou z dôležitých otázok je aj riziko hypoglykémie a prírastku na hmotnosti, a to najmä z hľadiska bezpečnosti a spolupráce pacienta. U pacientov so zvýšeným rizikom výskytu a dôsledkov hypoglykémie (KVO, epilepsia a pod) sa preferuje liečba farmakami s nízkym rizikom tohto nežiaduceho účinku (metformín, gliptíny, gliflozíny, aGLP1R, gliklazid MR, inzulín degludek, inzulín glargín 300 U/ml). Podobnou požiadavkou je minimalizácia prírastku na hmotnosti s preferenciou hmotnostne neutrálnych farmák (metformín, gliptíny, gliflozíny, aGLP1R).
Konečné rozhodnutie výberu liečby je však vždy individuálne, spočíva na rozhodnutí lekára a musí zohľadňovať nielen indikácie, ale najmä kontraindikácie, nežiaduce účinky a potenciálne riziká uvedené v SPC lieku. Efektivitu liečby treba kontrolovať pravidelne, obvykle v 3- až 6-mesačných intervaloch, ani intervaly medzi jednotlivými rozhodovacími procesmi intenzifikácie alebo zmeny liečby by nemali presiahnuť 3 až 6 mesiacov. V rámci hodnotenia efektivity a bezpečnosti liečby je okrem hodnotenia glykemickej kontroly potrebná pravidelná kontrola telesnej hmotnosti, ukazovateľov funkcií pečene a obličiek, možných kontraindikácií, interakcií, intolerancie a nežiaducich účinkov liečby. SPC sa považuje za medicínsko-právne záväzný materiál a jeho dodržiavanie vyžaduje aj správna klinická prax. Rovnako je potrebné dodržať indikačné obmedzenie (IO), čo je ekonomické obmedzenie liečby hradenej zo zdravotného poistenia. Ak sa liek predpisuje mimo indikačného obmedzenia, pacient si musí liek hradiť sám. Znenie aktuálnych indikačných obmedzení možno nájsť na http://www.health.gov.sk/Clanok?lieky201804.
Štítky
Diabetologie Endokrinologie Interní lékařstvíČlánek vyšel v časopise
Forum Diabetologicum

2018 Číslo Suppl 1
Nejčtenější v tomto čísle
- 18 Srdcové zlyhávanie: diagnostika, prevencia a zásady farmakologickej liečby
- 1 Diagnostika diabetes mellitus
- 12 Predoperačná príprava a peroperačné a pooperačné vedenie pacienta s diabetes mellitus a príprava na krátkotrvajúci zákrok alebo vyšetrenie
- 15 Dyslipidémie a ich manažment
