Nastal čas pre redukciu ischemickej choroby srdca pomocou ovplyvnenia sérového Lp(a)?
Has the time come for the reduction of ischemic heart disease through influencing Lp(a) levels?
Some genomic analyses have shown that LPA gene is associated with plasma concentration of Lp(a) which, in turn, is considered to be a causal risk factor for ischemic heart disease (ICHS). And it may be expected that the reduction of serum concentration of Lp(a) can favourably influence the development of ICHS. A meta-analysis of data from three databases (UK Biobank, CARDIOGRAM, MIGen, altogether 248,164 individuals) regarding the relation of Lp(a) serum reduction, by one standard deviation, to multiple cardiovascular diseases, has identified the reduction of the risk for ICHS by 29% , for peripheral arterial disease by 31% and stroke by 13% (all statistically relevant). That is, the reduction of serum Lp(a) as a result of LPA gene (the gene for Lp(a)) behaviour significantly affects the occurrence of cardiovascular diseases. We can assume that the effective therapeutic reduction of serum Lp(a) will bring about a cardiovascular benefit.
Key words:
cardiovascular diseasesserum, lipoprotein (a) Lp(a), serum Lp(a) reduction
Received:
14. 3. 2017
Accepted:
24. 3. 2017
Authors:
Ján Murín
Authors‘ workplace:
I. interná klinika LFUK a UNB, Nemocnica Staré Mesto, Bratislava
Published in:
Forum Diab 2017; 6(1): 39-41
Category:
Overview
Isté genomické analýzy preukázali, že LPA gén asociuje s plazmatickou koncentráciou Lp(a), a ten sa pokladá za kauzálny rizikový faktor ischemickej choroby srdca (ICHS). A možno predpokladať, že redukciou sérovej koncentrácie Lp(a) priaznivo ovplyvníme vývoj ICHS. Metaanalýza údajov troch databáz (UK Biobank, CARDIOGRAM, MIGen, spolu 248 164 osôb) o vzťahu redukcie Lp(a) v sére o jednu smerodajnú odchýlku k viacerým kardiovaskulárnym ochoreniam zistila redukciu rizika vzniku ICHS o 29 % , vzniku periférneho arteriálneho ochorenia o 31 % a vzniku mozgovej cievnej príhody o 13 % (všetko štatisticky významne). Teda redukcia sérového Lp(a) v dôsledku chovania sa génu LPA – gén pre Lp(a) – významne ovplyvňuje výskyt kardiovaskulárnych ochorení. Možno predpokladať, že účinná liečebná redukcia sérového Lp(a) prinesie kardiovaskulárny benefit.
Kľúčové slová:
kardiovaskulárne ochorenia, sérový lipoprotein (a) Lp(a), redukcia sérového Lp(a)
Úvod
Hlavným problémom v kardiovaskulárnej medicíne v Európe i na Slovensku je ischemická choroba srdca (ICHS), nakoľko je dominantnou príčinou kardiovaskulárnej (KV) morbidity a mortality [1]. V pozadí tohto ochorenia je ateroskleróza, ktorá sa vyvíja postupne už od narodenia, ale trvá dekády, kým sa klinicky prejaví. Medzi KV-rizikovými faktormi, ktoré podporujú aterogenézu, hrá hlavnú úlohu dyslipidémia, nakoľko bez sérového cholesterolu (lipidov v krvi) by tento proces neprebiehal.
Klinikom v tejto oblasti môže byť menej známym sérovým lipoproteinom „lipoprotein a“ – Lp(a). Lp(a) cirkuluje v krvi, v ktorej je apolipoprotein B na LDL-C častici modifikovaný kovalentnou väzbou s apolipoproteínom (a) [2]. Je známym faktom, že vyššie plazmatické hladiny Lp(a) sú asociované so zvýšeným rizikom vzniku ICHS, pričom hladina sérového Lp(a) je determinovaná geneticky [2,3]. Genetické varianty tzv. LPA génu – gén determinujúci sérovú hladinu Lp(a) – zvyšujú tiež riziko vzniku a progresie ICHS, teda Lp(a) je zrejme kauzálnym rizikovým faktorom vývoja ICHS [4,5]. A z toho samozrejme vyplýva, že redukcia sérových hladín Lp(a) by mohla byť tiež vhodným riešením pri prevencii vzniku i progresie vývoja ICHS [2,6].
Genetika sérového Lp(a)
Identifikácia génového lokusu zodpovedného za tvorbu sérového Lp(a) je dôležitá – napr. hľadaním možností ako tento genetický „lokus“ modifikovať, t.j. blokovať či inak minimalizovať jeho funkciu [7]. Isté mutácie LPA génu asociujú s vývojom ale aj s intenzitou ICHS [4,5], ďalej s vývojom stenózy aortálnej chlopne [8,9], ale pravdepodobne aj s inými KV-ochoreniami. Dnes nepoznáme celé fenotypové spektrum KV či iných ochorení, v pozadí ktorých je aktivita génového LPA lokusu. Na druhej strane iné observačné epidemiologické sledovania preukázali asociáciu nižších sérových hladín Lp(a) so zvýšeným rizikom vzniku onkologického ochorenia, ale aj rozvoja diabetu [10,11].
Fenotypická charakteristika osôb s nízkymi sérovými hladinami Lp(a)
Zaujímavá je štúdia autorov Emdin et al [12], ktorá sa sústredila na dlhodobé sledovanie osôb a na analyzovanie variácií už spomínaného LPA génu a ich vplyvu na fenotyp týchto osôb, či na zdravotné dôsledky pre týchto nositeľov. Analyzovali individuálne údaje z troch databáz:
- 112 338 osôb v tzv. UK Biobank
- údaje z CARDIOGRAM (Coronary Artery Disease Genome wide Replication and Metaanalysis), 42 335 osôb s ICHS a 78 240 osôb bez ICHS
- údaje od 15 251 osôb v MIGen (Myocardial Infarction Genetics)
Vo všetkých 3 uvedených databázach boli k dispozícii údaje genetické a klinické o ochoreniach zaradených a skúmaných osôb.
Cieľom štúdie bolo hľadať asociáciu medzi „geneticky“„ zníženými hodnotami sérového Lp(a) a 9 kardio-metabolickými ochoreniami (ICHS, mozgovou príhodou, srdcovým zlyhávaním, predsieňovou fibriláciou, aortálnou stenózou, periférnym vaskulárnym ochorením, venóznym trombo-embolickým ochorením, diabetom a chronickou obličkovou chorobou). Tiež analyzovali vzťah medzi poklesom sérového Lp(a) a 15 kardiometabolickými parametrami (pomer obvodov pás/boky, obvod pása, obvod bokov, BMI, systolický krvný tlak, podobne diastolický tlak, celkový cholesterol, LDL-C, HDL-C, triacylglyceroly v sére, glykémia nalačno, inzulinémia nalačno, 2-hodinová glykémia, HbA1c a glomerulárna filtrácia).
Genetické vyšetrenie lokusu LPA
V rámci genetických vyšetrení lokusu LPA boli analyzované 4 SNPs (single nucleotide polymorphisms) v LPA géne. Z histórie výskumu tohto lokusu sa vedelo, že asociujú s hladinou Lp(a) v sére a že isté genetické varianty (4 SNPs) redukovali sérovú hladinu Lp(a). Z týchto genetických analýz sa vytvorilo tzv. „genetické skóre“. Pre sledovanie redukcie Lp(a) autori zvolili hodnotu jednej smerodajnej odchýlky (SD) = 28 mg/dl Lp(a), čo bola logaritmická transformácia hladiny Lp(a).
Výsledky štúdie boli ohromujúce. Pokles sérovej hladiny Lp(a) – geneticky determinovaný – o jednu jednotku SD viedol k redukcii kardio-metabolických ochorení (tab) [12]. Nebol zistený vzťah medzi redukciou sérového Lp(a) a rozvojom diabetu, venóznym tromboembolizmom a ani s predsieňovou fibriláciou. Taktiež sa nepotvrdil tento vzťah ani s ďalšími 28 ochoreniami (4 sledované gastrointestinálne, 3 endokrinné, 2 renálne, 3 psychiatrické, 4 muskuloskletálne, 4 respiračné ochrenia a 8 onkologických ochorení). Významný bol vzťah medzi poklesom sérového Lp(a) a zlepšením glomerulárnej filtrácie: pokles sérového Lp(a) o jednu SD korešpondoval so vzostupom glomerulárnej filtrácie o 2,0 ml/min. Pochopiteľná bola asociácia poklesu sérového Lp(a) s poklesom celkového cholesterolu i LDL-cholesterolu (pokles sérového Lp(a) o jednu SD asocioval s poklesom sérového celkového cholesterolu o 5,6 mg/dl a s poklesom sérového LDL-C o 4,9 mg/dl). Nebola pozorovaná asociácia poklesu sérového Lp(a) s už spomínanými 15 kardiometabolickými parametrami.
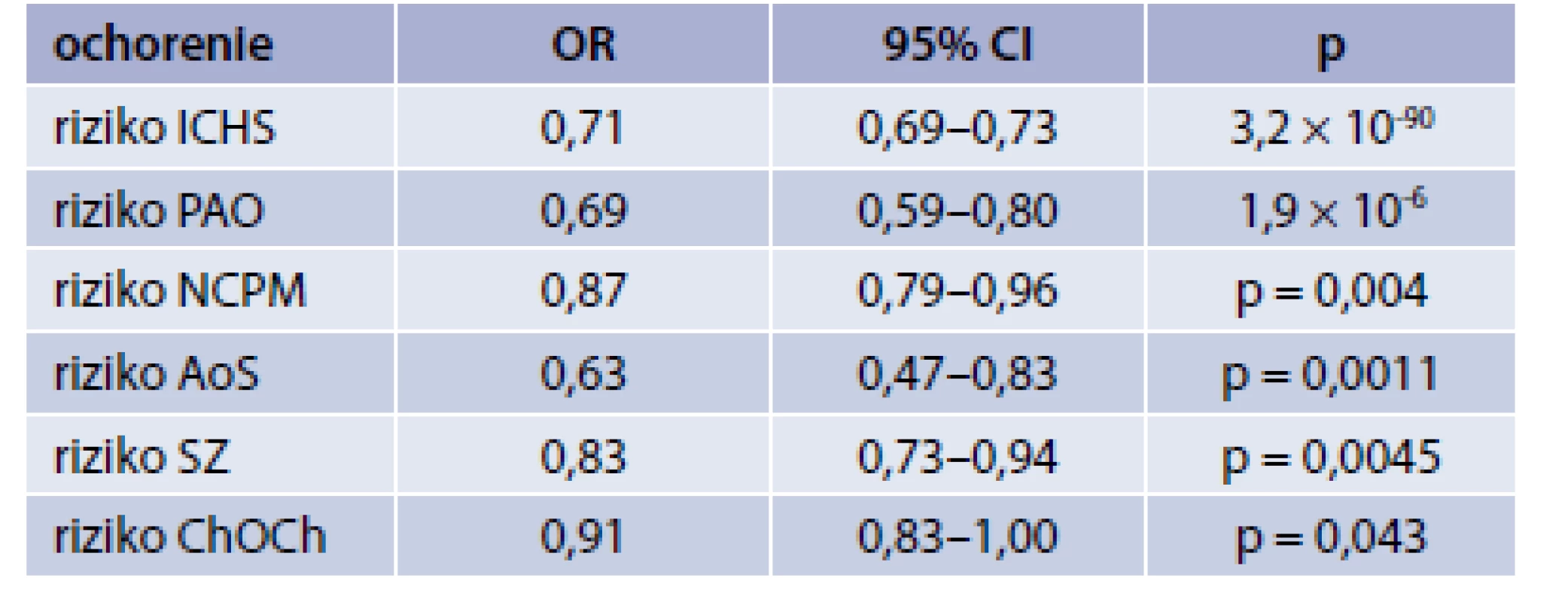
Autori ešte analyzovali aj ďalšie funkcie génu LPA v spomínanom lokuse – niektoré boli charakteru zvýšenia funkcie (gain of function), iné zníženia funkcie lokusu (loss of function). Výskyt ICHS či riziko vzniku ICHS súviseli s tým, či genetická varianta lokusu LPA zvýšila alebo znížila sérovú hladinu Lp(a).
Aký je klinický odkaz tejto genetickej analýzy lokusu LPA?
Ak je zvýšenie sérového Lp(a) vyvolané geneticky, tak u týchto osôb dochádza k vzostupu KV-rizika, hlavne výskytu ICHS. Možno „špekulovať“, či uvažovať o tom, či vhodná a účinná farmakologicky navodená a súčasne dlhodobá redukcia sérovej hladiny Lp(a) bude viesť k redukcii rizika pre vývoj KV-ochorení, hlavne pre vývoj ICHS. Zaujímavým zistením bola v štúdii i tá skutočnosť, že geneticky regulovaný pokles sérového Lp(a) zlepšuje aj funkciu obličky (glomerulárnu filtráciu). I tu možno predpokladať, že za týmto výsledkom sa skrýva nižšie riziko rozvoja renálnej aterosklerózy.
Posolstvo
Máme možnosti ako farmakologicky ovplyvniť hladiny sérového Lp(a)? Donedávna tomu tak nebolo. Ale skúsenosti s inhibítormi PCSK9, novými liekmi určenými na redukciu sérového cholesterolu, poukazujú na základe už publikovaných údajov, že tieto nové liečivá vedia redukovať aj sérovú hladinu Lp(a). Súčasne môžeme konštatovať, že nepoznáme iné liečivá, ktoré by v nedávnej minulosti či prítomnosti vedeli sérovú hladinu Lp(a) priaznivo ovplyvniť, čiže redukovať. I v tomto spôsobe intervencie – redukcia Lp(a) – môže byť skrytý benefit tejto novej skupiny liekov.
Práca podporená grantom VEGA 1/0112/17
Doručené do redakcie 14. 3. 2017
Prijaté po recenzii 24. 3. 2017
prof. MUDr. Ján Murín, CSc., FESC
jan.murin@gmail.com
www.unb.sk
Sources
1. Gaziano TA, Prabhakaran D, Gaziano JM, Global burden of cardiovascular disease. In: Mann DL et al. Braunwald’s Heart Disease. 10th ed. Elsevier Canada 2015: 1–20. ISBN: 978–1-4557–5133–4.
2. Tsimikas S, Hall JL. Lipoprotein(a) as a potential causal genetic risk factor of cardiovascular disease: a rationale for increased efforts to understand its pathophysiology and develop targeted therapies. J Am Coll Cardiol 2012; 60(8): 716–721.
3. Emerging Risk Factors Collaboration, Erqou S, Kaptoge S et al. Lipoprotein(a) concentration and the risk of coronary heart disease, stroke, and nonvascular mortality. JAMA 2009; 302(4): 412–423.
4. Clarke R, Peden JF, Hopewell JC et al. Genetic variants associated with Lp(a) lipoprotein level and coronary disease. N Engl J Med 2009; 361(26): 2518–2528.
5. Kamstrup PR, Tybjaerg-Hansen A, Steffensen R et al. Genetically elevated lipoprotein(a) and increased risk of myocardial infarction. JAMA 2009; 301(22): 2331–2339.
6. Tsimikas S, Viney NJ, Hughes SG et al. Antisense therapy targeting apolipoprotein(a): a randomised, double-blind, placebo-controlled phase 1 study. Lancet 2015; 386(10002):1472–1483.
7. Plenge RM, Scolnick EM, Altshuler D. Validating therapeutic targets through human genetics. Nat Rev Drug Discov 2013; 12(8): 581–594.
8. Thanassoulis G, Campbell CY, Owens DS et al. Genetic associations with valvular calcification and aortic stenosis. N Engl J Med 2013; 368(6): 503–512.
9. Kamstrup PR, Tybjaerg-Hansen A, Nordestgaard BG. Elevated lipoprotein(a) and risk of aortic valve stenosis in the general population. J Am Coll Cardiol 2014; 63(5):470–477.
10. Sawabe M, Tanaka N, Mieno MN et al. Low lipoprotein(a) concentration is associated with cancer and all-cause deaths: population-based cohort study (the JMS cohort study). PLoS ONE 2012;7:e31954. Dostupné z DOI: <http://doi:10.1371/journal.pone.0031954>.
11. Mora S, Kamstrup PR, Rifai N et al. Lipoprotein(a) and risk of type 2 diabetes. Clin Chem 2010; 56(8): 1252–1260.
12. Endim CA, Khea AV, Natarajan P et al. Phenotypic characterization of genetically lowered human lipoprotein(a) levels. J Am Coll Cardiol 2016; 68(25): 2761–2772.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Forum Diabetologicum

2017 Issue 1
Most read in this issue
- Angio OCT – nová neinvazívna zobrazovacia vyšetrovacia metóda diagnostiky a monitoringu diabetickej retinopatie
- Autoimunita a diabetes mellitus
- Metabolické choroby a oko v detskom veku
- Diabetes mellitus a dermatologické ochorenia
